A microbiota intestinal (MI), complexo conjunto de microrganismos, se estabelece ao longo da vida a partir do nascimento. No útero, o bebê é considerado praticamente estéril, quando a gestação é normal, e adquire , ao nascer, microrganismos por transmissão materna e do ambiente hospitalar.

Ligações patogênicas emergentes entre a microbiota e o eixo intestino-pulmão
Nature Reviews Microbiology 15 , 55–63 ( 2017 )
Pontos chave
O trato gastrointestinal (TGI) e o trato respiratório, embora órgãos separados, fazem parte de um sistema imunológico da mucosa compartilhado denominado eixo intestino-pulmão.
A microbiota do GIT e do trato respiratório está envolvida no eixo intestino-pulmão, influenciando as respostas imunológicas tanto localmente quanto em locais distantes.
A pesquisa atual identificou táxons bacterianos específicos, seus componentes e metabólitos que podem influenciar a imunidade do hospedeiro.
Com um maior conhecimento do eixo intestino-pulmão e das influências microbianas da imunidade, avanços foram feitos no entendimento do papel da microbiota nas doenças respiratórias, como asma, doença pulmonar obstrutiva crônica (DPOC) e infecção respiratória.
Esse novo entendimento criou várias estratégias terapêuticas possíveis para o tratamento ou prevenção de doenças respiratórias agudas e crônicas. No entanto, vários desafios técnicos e perguntas sem resposta permanecem.
Resumo
A microbiota é vital para o desenvolvimento do sistema imunológico e da homeostase. Mudanças na composição e função microbiana, denominadas disbiose, no trato respiratório e no intestino foram recentemente associadas a alterações nas respostas imunológicas e ao desenvolvimento de doenças nos pulmões. Neste artigo de opinião, revisamos as espécies microbianas que geralmente são encontradas nos tratos gastrointestinal e respiratório saudáveis, sua disbiose em doenças e as interações com o eixo intestino-pulmão. Embora o eixo intestino-pulmão esteja apenas começando a ser compreendido, evidências emergentes indicam que há potencial para a manipulação da microbiota intestinal no tratamento de doenças pulmonares.
Principal
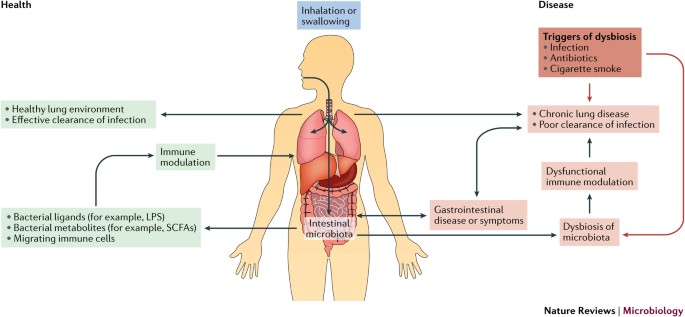
Doenças pulmonares crônicas, como asma e doença pulmonar obstrutiva crônica (DPOC), são comuns e costumam ocorrer junto com doenças crônicas do trato gastrointestinal (TGI), como doença inflamatória intestinal (DII) ou síndrome do intestino irritável (SII) 1 , 2 . Até 50% dos adultos com DII e 33% dos pacientes com SII têm envolvimento pulmonar, como inflamação ou função pulmonar prejudicada, embora muitos pacientes não tenham história de doença respiratória aguda ou crônica 3 , 4 . Além disso, os pacientes com DPOC têm 2 a 3 vezes mais probabilidade de serem diagnosticados com DII 4. Indivíduos com asma apresentam alterações funcionais e estruturais na mucosa intestinal, e pacientes com DPOC tipicamente apresentam aumento da permeabilidade intestinal 2 , 5 . Embora o TGI maduro e o trato respiratório tenham ambientes e funções diferentes, eles possuem a mesma origem embrionária e, conseqüentemente, apresentam semelhanças estruturais. Assim, não é surpreendente que os dois locais possam interagir na saúde e na doença ( Fig. 1 ); no entanto, os mecanismos subjacentes não são bem compreendidos.
Uma microbiota intestinal saudável mantém respostas imunológicas locais homeostáticas por meio da exposição de ligantes estruturais (por exemplo, lipopolissacarídeo (LPS) e / ou peptidoglicano) e metabólitos secretados (por exemplo, ácidos graxos de cadeia curta (SCFAs)). Os microorganismos invasores e os metabólitos absorvidos influenciam os linfócitos circulantes e contribuem para a regulação das respostas imunes sistêmicas. Quando a microbiota intestinal é perturbada, por exemplo, durante infecção ou exposição a antibióticos, os sinais derivados da microbiota normal são alterados, o que leva a uma resposta imune alterada. No início da vida, quando o sistema imunológico ainda está em desenvolvimento, esse distúrbio pode alterar substancialmente a maneira como o sistema imunológico percebe o que está à sua volta na vida adulta, o que pode levar ao desenvolvimento de doenças inflamatórias crônicas no intestino e no pulmão. Na idade adulta, a disbiose da microbiota intestinal, por exemplo, por meio da exposição à fumaça do cigarro, pode causar inflamação sistêmica e uma proliferação de patógenos oportunistas, que podem levar à inflamação crônica em locais distais. Embora os táxons específicos, ligantes, metabólitos e / ou respostas do hospedeiro possam diferir em situações específicas de doenças, esses princípios gerais delineiam o papel da microbiota na crosstalk intestinal-pulmão.
Uma área emergente de intenso interesse é a influência da microbiota associada ao hospedeiro na imunidade local e sistêmica. Isso é exemplificado em camundongos livres de germes, que não possuem um sistema imunológico adequadamente desenvolvido e apresentam alterações da mucosa, as quais podem ser restauradas por meio da colonização com a microbiota intestinal 6 , 7 . A microbiota muda ao longo do tempo, desde o nascimento até a idade adulta e até a velhice e em resposta a fatores ambientais, como dieta e exposição a drogas e ao meio ambiente 8 .
Neste campo em constante expansão, os pesquisadores agora estão investigando como a microbiota local influencia a imunidade em locais distais, em particular como a microbiota intestinal influencia outros órgãos, como o cérebro, o fígado ou os pulmões. Isso levou à criação de termos como 'eixo intestino-cérebro' e 'eixo intestino-pulmão'. Por exemplo, alterações induzidas por antibióticos na microbiota intestinal no início da vida aumentam o risco de desenvolver doença alérgica das vias aéreas 9 , 10 , 11 , 12 ; tais descobertas aumentam a nossa compreensão das ligações entre a exposição a microrganismos e alergia e autoimunidade ( Caixa 1) Os mecanismos pelos quais a microbiota intestinal afeta as respostas imunológicas nos pulmões, e vice-versa, estão sendo descobertos, mas muitas questões permanecem. Neste artigo de opinião, resumimos o papel emergente da microbiota no eixo intestino-pulmão, destacando lacunas em nosso conhecimento e o potencial para intervenção terapêutica.
Microbiota do intestino e pulmões saudáveis
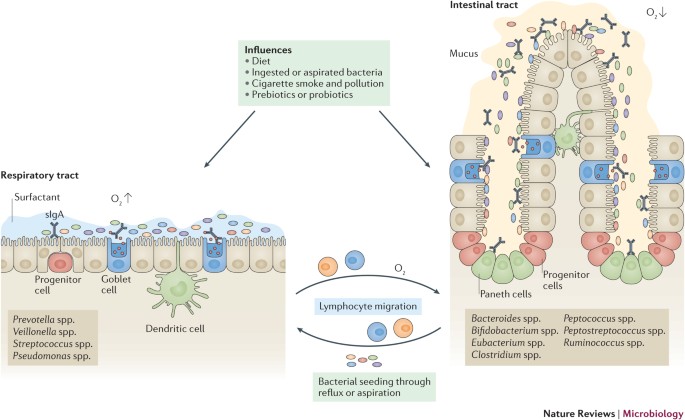
O GIT permanece, de longe, o ecossistema microbiano associado ao hospedeiro mais bem estudado, em parte devido à sua abundância de microrganismos e em parte porque a microbiota pode ser perfilada através de fezes, o que é facilmente obtido. Tanto a abundância quanto a diversidade da microbiota comensal geralmente aumentam ao longo do TGI, e há variações específicas do local na mucosa e no lúmen 13 , 14 . Essas diferenças são governadas pelo ambiente predominante, incluindo pH, concentração de ácidos biliares, tempo de retenção da digesta, propriedades da mucina e fatores de defesa do hospedeiro 15. Apesar dessas variações, o GIT é dominado por membros de apenas quatro filos bacterianos, Firmicutes, Bacteroidetes, Proteobacteria e Actinobacteria; com representação menor e esporádica de outros filos, incluindo Fusobacteria, Verrucomicrobia e Spirochaetes. Esta comunidade microbiana intestinal 'central' compreende até 14 gêneros bacterianos e 150 'espécies' bacterianas, muitas das quais ainda não foram cultivadas 16 , 17 , 18 .
Estamos começando a entender a microbiota pulmonar por meio de programas como o Lung HIV Microbiome Project, que é um estudo multicêntrico que examina indivíduos infectados com HIV e indivíduos não infectados com históricos variados de doenças pulmonares e / ou respiratórias 19 . Os pulmões têm uma grande área de superfície com alta exposição ambiental e são equipados com defesas antimicrobianas eficazes. Por muito tempo, os pulmões saudáveis foram considerados estéreis; no entanto, o advento de abordagens independentes de cultura para o perfil da comunidade microbiana resultou na detecção de DNA microbiano nos pulmões de indivíduos saudáveis 19 , 20. Esses microrganismos provavelmente atingiram os pulmões a partir da cavidade oral por meio de microaspiração, pois os perfis taxonômicos dos dois locais eram semelhantes 19 , 20 . Em comparação com os locais circundantes, os pulmões tiveram uma abundância diminuída de taxa filiados a Prevotella e um enriquecimento de Proteobacteria, especificamente Enterobacteriaceae, Ralstonia spp. E Haemophilus spp. 19, que pode ter resultado da imunidade do hospedeiro e do ambiente, como estado redox e disponibilidade de oxigênio. A microbiota pulmonar pode não residir em indivíduos saudáveis, mas sim ser recolonizada temporariamente por meio de microaspiração e respiração. Os pulmões têm uma biomassa microbiana comparativamente baixa e uma composição notavelmente semelhante aos locais adjacentes, embora os pulmões estejam continuamente expostos à entrada de microorganismos e suas condições ambientais sejam muito diferentes das de outros locais do corpo. Essas observações apoiam a hipótese de que a entrada e a eliminação seletiva de uma microbiota transitória é o principal determinante da composição microbiana nos pulmões, ao invés de microrganismos residentes e viáveis. Isso não nega a importância das interações hospedeiro-microorganismo nos pulmões,21 . Em vez disso, destaca o delicado equilíbrio entre a exposição e a eliminação microbiana; a possibilidade de disbiose em locais orais precedendo e / ou causando disbiose nos pulmões e contribuindo para a patogênese da doença 19 ; e a importância de distinguir se o DNA microbiano que é detectado por técnicas independentes de cultura é verdadeiramente representativo de bactérias viáveis nos pulmões 22. Desafios técnicos, como baixa biomassa microbiana e contaminação por broncoscópio, semeadura constante de locais orais e GIT e depuração mucociliar e imune, têm impedido a identificação de uma microbiota viável e residente, ou uma recolonização transitória, microbiota nos pulmões, bem como outros pesquisa em interações hospedeiro-microorganismo. Novos métodos de amostragem de tecido com contaminação mínima 23 , estudos longitudinais para identificar mudanças temporais na microbiota e o uso crescente de análises metagenômicas para facilitar o cultivo de espécies bacterianas fastidiosas 24, fornecerá uma imagem mais clara do papel da microbiota respiratória e permitirá o melhor desenho de estudos de intervenção para desenvolver uma compreensão mais completa das interações microorganismo-hospedeiro nos pulmões.
Interações entre o intestino e os pulmões
Interações de microrganismos entre os locais. As superfícies epiteliais do TGI e do trato respiratório estão expostas a uma ampla variedade de microrganismos; microorganismos ingeridos podem acessar ambos os locais e a microbiota do GIT pode entrar nos pulmões por aspiração. Tanto o intestino quanto a mucosa respiratória fornecem uma barreira física contra a penetração microbiana, e a colonização pela microbiota normal gera resistência aos patógenos; por exemplo, por meio da produção de bacteriocinas 15 . Além disso, uma coleção de bactérias do intestino comensal em rápida expansão, incluindo bactérias filamentosas segmentadas (SFB), Bifidobacterium spp. e membros dos Bacteroides do cólongênero, induzem a produção de peptídeos antimicrobianos, imunoglobulina A secretora (sIgA) e citocinas pró-inflamatórias. Cepas de Salmonella não patogênicas regulam negativamente as respostas inflamatórias em células epiteliais GIT ao inibir a ubiquitilação do inibidor-α (NF-κB) do fator nuclear-κB (IκBα) 25 , enquanto alguns Clostridium spp. promovem respostas de células T regulatórias anti-inflamatórias (células T reg ) 26 . No trato respiratório, Streptococcus pneumoniae e Haemophilus influenzae ativam sinergicamente a proteína quinase ativada por mitogênio p38 do hospedeiro (MAPK) de uma maneira independente do receptor Toll-like (TLR) para amplificar as respostas pró-inflamatórias 27. Por outro lado, S. pneumoniae não patogênico e outras bactérias e seus componentes podem suprimir a doença alérgica das vias aéreas por meio da indução de células T reg 28 , 29 , 30 , 31 . Em receptores de transplantes de pulmão, a microbiota do trato respiratório altera a imunidade nos pulmões. Disbiose dominada por Firmicutes e dominada por Proteobacteria foram associadas à expressão de genes inflamatórios em leucócitos pulmonares, enquanto disbiose dominada por Bacteroidetes foi associada a um perfil de expressão gênica característico de remodelação tecidual 32 . Em ambas as culturas de células 32 e modelos animais 33, a resposta inflamatória induzida por espécies patogênicas é maior do que a resposta induzida por microrganismos comensais, o que indica que uma microbiota pulmonar diversa protege contra a patologia ao 'diluir' os estímulos mais pró-inflamatórios dos patógenos. Embora a transferência de microrganismos de suspensões fecais tenha sido usada para determinar o papel da microbiota intestinal, tais técnicas ainda não foram usadas para transferir a microbiota respiratória entre animais, o que limita nossa compreensão de seus papéis.
Vários estudos demonstraram os efeitos da colonização do GIT com bactérias administradas por via oral na função pulmonar. A gavagem oral de suspensões fecais em camundongos que foram primeiro tratados com antibióticos proporcionou melhorias de curto prazo em algumas, mas não em todas as medidas em um modelo de infecção por S. pneumoniae 34. Embora a natureza deste 'eixo intestino-pulmão' tenha sido questionada devido para os potenciais efeitos de confusão da administração fecal por gavagem oral e uso de antibióticos 35 , o conceito garante uma avaliação sistemática e controlada. Em bebês, a composição da microbiota intestinal e a cesariana têm sido associadas a manifestações atópicas e colonização por Clostridium difficilecom um mês de idade foi associado a sibilos e eczema durante o início da vida, e com asma após 6–7 anos 36 . Também foram identificadas associações positivas entre a presença de bactérias 'benéficas', como Bifidobacterium longum , no intestino e uma menor incidência de asma 37 , embora estudos maiores e mais longos sejam necessários para avaliar essas associações.
Evidências consideráveis sugerem que os epitélios do hospedeiro e outras células estruturais e imunes assimilam informações diretamente dos microrganismos e da resposta de citocinas locais concomitantes para ajustar as respostas inflamatórias, e que isso molda as respostas imunes em locais distais, como os pulmões 38 , 39 ( Fig. 2 ) Há menos evidências de transferência direta de microrganismos entre os locais, embora a translocação de bactérias do GIT para os pulmões tenha sido observada na sepse e na síndrome do desconforto respiratório agudo, em que a integridade da barreira está comprometida 40 . Além disso, alguns fatores ambientais, como fibra alimentar, podem produzir alterações semelhantes na microbiota do TGI e dos pulmões 39. Se estes resultam de mudanças impulsionadas pela dieta nos metabólitos microbianos, mudanças nas respostas imunes inatas ou uma combinação de ambos, permanece para ser determinado.
Os epitélios do intestino e do trato respiratório têm diferenças substanciais no propósito funcional e existem em ambientes diferentes; no entanto, eles retêm algumas semelhanças anatômicas. Ambos são derivados do endoderma e consistem em células epiteliais colunares com projeções de microvilosidades (intestino) ou cílios (trato respiratório) que funcionam como uma barreira física e como sentinelas do sistema imunológico em conjunto com o tecido linfóide associado. Ambos secretam muco através das células caliciformes, bem como imunoglobulina A secretora (sIgA; embora menos no pulmão). Os alvéolos encontrados nas vias aéreas terminais dos pulmões diferem substancialmente, consistindo em células epiteliais escamosas que secretam surfactante (células alveolares tipo 2) ou funcionam na troca gasosa (células alveolares tipo 1). No entanto, as semelhanças terminam aqui: o lúmen intestinal é um ambiente pobre em oxigênio e funciona para digerir os alimentos e absorver nutrientes. O movimento da matéria é unidirecional (boca para o ânus), com exceção de refluxo ou vômito. Além disso, o pH, a presença da enzima e a estrutura variam ao longo do trato gastrointestinal (TGI). Em contraste, o trato respiratório e os alvéolos são ricos em oxigênio e o movimento é bidirecional (inspiração e expiração). A temperatura no intestino é relativamente uniforme a 37 ° C, enquanto a temperatura no trato respiratório difere dependendo da proximidade com a faringe. Assim, não é surpreendente que a vida microbiana em cada ambiente seja distinta. Mudanças na dieta alimentar e exposição a terapêuticas e particulados ambientais podem afetar diretamente a composição da microbiota. Tanto o intestino quanto os pulmões são capazes de influenciar um ao outro ' s respostas imunológicas. Células dendríticas nos intestinos e trato respiratório e macrófagos nos pulmões, amostras de antígenos no lúmen. Os linfócitos nos tecidos linfoides associados circulam pelo sistema linfático para afetar a imunidade sistêmica. As bactérias do intestino podem viajar para os pulmões através da aspiração de vômito ou refluxo esofágico. Durante os períodos de disbiose, a integridade epitelial alterada pode permitir que bactérias e seus componentes e metabólitos entrem no sistema circulatório, o que pode causar inflamação sistêmica. As bactérias do intestino podem viajar para os pulmões através da aspiração de vômito ou refluxo esofágico. Durante os períodos de disbiose, a integridade epitelial alterada pode permitir que bactérias e seus componentes e metabólitos entrem no sistema circulatório, o que pode causar inflamação sistêmica. As bactérias do intestino podem viajar para os pulmões através da aspiração de vômito ou refluxo esofágico. Durante os períodos de disbiose, a integridade epitelial alterada pode permitir que bactérias e seus componentes e metabólitos entrem no sistema circulatório, o que pode causar inflamação sistêmica.
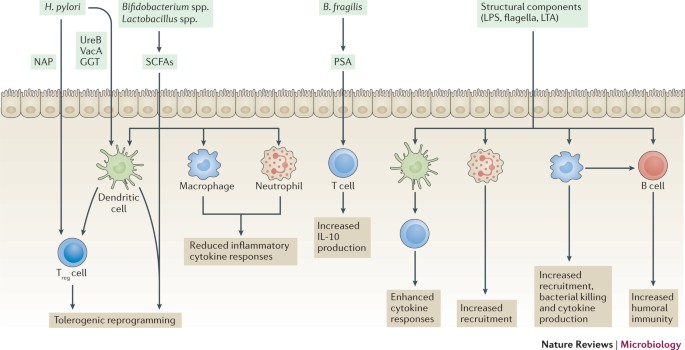
Efeitos específicos da espécie microbiana na imunidade do hospedeiro. O papel crucial da microbiota na homeostase e imunidade pulmonar é demonstrado pelos resultados ruins de camundongos livres de germes que foram expostos a infecções agudas 41 e sua suscetibilidade a doenças alérgicas das vias aéreas 42 . A pesquisa atual está avaliando os efeitos de membros selecionados da microbiota intestinal comensal na imunidade sistêmica, incluindo nos pulmões, bem como o uso de probióticos e prebióticos para prevenir e tratar doenças pulmonares agudas e crônicas ( Fig. 3 ). Por exemplo, SFB no intestino, quando presente naturalmente ou introduzido por dosagem probiótica ou co-alojamento de camundongos, estimulourespostaspulmonares T auxiliares 17 (T H 17) e proteção contraInfecção por S. pneumoniae e mortalidade 43 . Curiosamente, uma microbiota respiratória enriquecida com táxons orais, como Prevotella spp. , Rothia spp. e Veillonella spp., foi associada à imunidade mediada por T H 17 nos pulmões de hospedeiros humanos saudáveis 21 . Se essas ligações são correlativas ou causais, ainda não está claro. A exposição de camundongos à poeira doméstica associada a cães alterou a microbiota cecal e, em particular, aumentou a abundância de Lactobacillus johnsonii e outras linhagens relacionadas a Firmicutes, como espécies nas famílias Peptococcaceae e Lachnospiraceae 44. Os camundongos que foram expostos à poeira do cão ou inoculados com L. johnsonii mostraram diminuições nas respostas das citocinas T H 2 do trato respiratório , e o tratamento com L. johnsonii protegeu contra a exposição ao vírus sincicial respiratório e alérgenos como ovalbumina. Outros exemplos de influências microbianas na imunidade do hospedeiro incluem a capacidade de vários Bacteroides spp. para expandir T reg populações de células ou a polarização T H 1 / T H2 fenótipo em qualquer direção de uma maneira específica da cepa, ou a supressão das respostas inflamatórias do hospedeiro pelos metabólitos bacterianos comuns de ácidos graxos de cadeia curta (SCFAs), que agem através dos receptores de ácidos graxos livres (FFA) e / ou regulação epigenética do sistema imunológico células 45 .
Componentes secretados e estruturais de microrganismos podem influenciar a resposta imune do hospedeiro tanto localmente quanto em sítios distais. Os metabólitos microbianos, como os ácidos graxos de cadeia curta (SCFAs), ligam-se aos receptores de ácidos graxos livres ou promovem alterações epigenéticas nos leucócitos do hospedeiro, que induzem respostas antiinflamatórias e diminuem a inflamação. Fatores de virulência de bactérias patogênicas, como Helicobacter pylori ou Bacteroides fragilis , podem diminuir as respostas imunes do hospedeiro, enquanto componentes estruturais de bactérias comensais podem influenciar as respostas inflamatórias por meio da ativação de receptores de reconhecimento de padrões. GGT, γ-glutamil transpeptidase; IL-10, interleucina-10; LPS, lipopolissacarídeo; LTA, ácido lipoteicóico; NAP, proteína ativadora de neutrófilos; PSA, polissacarídeo A; Tcélula reg , célula T reguladora; UreB, subunidade-β da urease; VacA, citotoxina vacuolante A.
Em estudos humanos relacionados, a soropositividade para o patógeno específico do intestino Helicobacter pylori , em particular, cepas positivas do gene A associado à citotoxina ( cagA + ), há muito tempo é associada à diminuição da incidência de asma e alergia 46 , 47 , 48 . Por outro lado, duas metanálises recentes sugerem que a infecção por H. pylori está positivamente associada ao aumento da incidência de DPOC e outras doenças brônquicas crônicas 49 . Embora essas diferenças possam ser parcialmente atribuídas a fatores genéticos, ambientais e de estilo de vida, essas descobertas levantam a possibilidade de que as respostas imunológicas sistêmicas que são desencadeadas pelo H. pyloripode ter diferentes papéis na etiologia de diferentes doenças pulmonares. As variações da cepa, além da expressão de cagA , também podem afetar as respostas das células T reg 50 .
Claramente, a incrível diversidade e abundância de espécies na microbiota intestinal resultam em muitos sinais imunomoduladores, que têm efeitos combinados consideráveis na saúde do hospedeiro. Embora muito tenha sido descoberto sobre a atividade de espécies bacterianas específicas, a pesquisa atual apenas começou a avaliar as relações estrutura-função da microbiota intestinal e pulmonar com a imunidade do hospedeiro.
Componentes e metabólitos da microbiota intestinal que influenciam o pulmão. Os primeiros estudos mostraram que camundongos livres de germes têm capacidade de resposta reduzida à patologia induzida por lipopolissacarídeo (LPS) e que essa tolerância oral a componentes microbianos foi devido à hiporresponsividade mediada por interleucina-10 (IL-10); no entanto, a exposição subsequente ao LPS não foi mais tolerada e a resposta imune tornou-se semelhante à observada em camundongos convencionais 51 , 52 . Além disso, uma resposta robusta ao LPS por macrófagos colônicos poderia ser restaurada por microrganismos comensais 53 .
Os componentes bacterianos também podem ter efeitos antiinflamatórios, que atenuam a patologia do TGI. O polissacarídeo A (PSA) de Bacteroides fragilis induz a produção de IL-10 pelas células T e protege contra doenças inflamatórias intestinais causadas quimicamente ou por infecção por Helicobacter hepaticus 54 . Os esfingolipídios, que são componentes naturais da membrana celular de muitos gêneros anaeróbicos do intestino, incluindo Bacteroides , diminuem o número de células T assassinas naturais invariantes no cólon - células que têm sido implicadas no desenvolvimento da colite 55. Os metabólitos mais estudados, os AGCCs, são subprodutos da fermentação microbiana da fibra alimentar, têm propriedades antiinflamatórias, são fonte de energia para os colonócitos e regulam a síntese de ácidos graxos e lipídios no hospedeiro 56 .
Muito menos se sabe sobre a influência dos componentes microbianos e metabólitos em outros locais, incluindo os pulmões. Diminuições em Faecalibacterium spp., Lachnospira spp., Veillonella spp. e Rothia spp. no intestino, e os níveis urinários de alguns metabólitos microbianos do ácido biliar se correlacionam com o desenvolvimento de sibilância atópica em crianças, embora não se saiba se eles são uma causa ou consequência da sibilância 12 . A administração oral de SCFAs demonstrou experimentalmente aliviar a doença alérgica das vias aéreas 39 , 57. Componentes e metabólitos microbianos têm sido implicados em outros distúrbios, como o triptofano na saúde do cérebro, o PSA em distúrbios do sistema nervoso central e o N- óxido de trimetilamina na aterosclerose, o que destaca ainda mais sua importância em ambientes extra-intestinais 55 . Em estudos de outras doenças, Bacteroides spp. foram associados a doenças autoimunes de início precoce, o que pode ser uma consequência da potente ativação da imunidade por LPS produzido por essas bactérias 58 .
Microbiota intestinal e doenças pulmonares
Asma. Um risco aumentado de asma tem sido relacionado à ruptura da microbiota intestinal no início da vida ( Quadro 1 ), e vários estudos procuraram caracterizar os constituintes microbianos precisos que estão associados ao desenvolvimento da doença em bebês.
A composição geral da comunidade microbiana intestinal não é alterada em bebês com risco de desenvolver asma, mas mudanças transitórias sutis em taxa selecionadas podem ser detectadas nos primeiros meses de vida 12 , 59 . O aumento do risco de asma tem sido associado a um aumento na abundância de B. fragilis e anaeróbios totais no início da vida 60 , bem como a redução da diversidade microbiana 59 e diminuições em Escherichia coli 61 e as abundâncias relativas de Faecalibacterium spp., Lachnospira spp. , Rothia spp. e Veillonella spp. 12, embora esses resultados não tenham sido consistentes em todos os estudos. Além disso, embora os modelos de doença alérgica das vias aéreas apoiem a existência de uma janela crítica de desenvolvimento no início da vida 42 , 62 , apenas um estudo forneceu evidências diretas de que a restauração da microbiota intestinal alterada por meio do tratamento probiótico pode diminuir a suscetibilidade à asma 12 .
Da mesma forma, em adultos, a composição geral da microbiota fecal em indivíduos com asma alérgica não difere de indivíduos saudáveis 63 , 64 . Existem diferenças táxons específicas, como o enriquecimento por Bifidobacterium adolescentis , que se correlacionou negativamente com o tempo desde o diagnóstico de asma 63 . Curiosamente, Bifidobacterium spp. que foram isolados de bebês com asma alérgica induziram respostas pró-inflamatórias maiores do que aqueles isolados de indivíduos saudáveis 65 .
Existem vários mecanismos propostos pelos quais a microbiota intestinal pode atenuar o risco de desenvolver asma. Bebês que estavam em risco de desenvolver asma tiveram níveis diminuídos de LPS em suas fezes 12 , enquanto o PSA de B. fragilis protegeu contra o desenvolvimento de doença alérgica das vias aéreas em camundongos, induzindo respostas de IL-10 em células T 66 . H. pylori aliviou a doença alérgica das vias aéreas em murinos de várias maneiras, nomeadamente através da ativação direta de células T reg pela proteína 67 ativadora de neutrófilos , ou indiretamente através da subunidade β da urease, que promove a reprogramação tolerogénica de células dendríticas 68. Além disso, a γ-glutamil transpeptidase e a citotoxina vacuolizante de H. pylori alteraram a função das células dendríticas, mas não exigiram células T reg para aliviar os sintomas 69 . Bactérias comensais também podem influenciar o desenvolvimento da asma por meio da produção e secreção de metabólitos, especificamente SCFAs. O risco de asma em bebês foi associado a uma diminuição na concentração de acetato nas fezes 12 e inversamente correlacionado com as concentrações de acetato sérico em suas mães quando estavam grávidas 57. Uma dieta rica em fibras, que aumentou os níveis de SCFAs no soro e nas fezes, protegeu os camundongos contra o desenvolvimento de sintomas de asma, um fenômeno que poderia ser replicado por meio da administração direta de acetato ou propionato antes do início da doença para promover respostas imunes tolerogênicas em células dendríticas e células T reg 39 , 57. Os benefícios de uma dieta rica em fibras foram associados a uma proporção diminuída de Firmicutes / Bacteroidetes e um enriquecimento de Bacteroidaceae nas fezes e nos pulmões, o que destaca a necessidade de investigar as comunidades microbianas em vários locais do corpo para um entendimento completo da influência de microrganismos na saúde do hospedeiro. Esses estudos não exploraram diretamente a relação entre a composição das comunidades microbianas nos dois locais, ou a importância relativa da microbiota intestinal ou pulmonar na proteção contra doenças. Esses estudos seriam valiosos para determinar qual local do corpo atingir com intervenções terapêuticas. Uma área importante, mas pouco estudada, é o papel que as interações entre microrganismos têm no desenvolvimento da asma. Por exemplo,2 - alterações induzidas em macrófagos alveolares e aumento da inflamação alérgica das vias aéreas 70 . Além disso, a infecção por helmintos intestinais protegeu camundongos contra doença alérgica das vias aéreas, que foi associada a um aumento na abundância de Lachnospiraceae e outros membros de Clostridiales, a produção de SCFAs e subsequentes respostas robustas de células T reg nos pulmões 71 . Embora o T reg capacidade de promover a célula de Clostridium spp. já foi demonstrado no cólon 26 , 72 , está cada vez mais sendo explorado para o tratamento de doenças em outras partes do corpo, incluindo asma 73 , 74 .
DPOC. A pesquisa da microbiota respiratória na DPOC tem avaliado mudanças no estado da doença e com a exposição à fumaça, que é um importante fator de risco para o desenvolvimento da doença. Curiosamente, embora a microbiota pulmonar seja semelhante em fumantes saudáveis e não fumantes, a microbiota oral difere substancialmente entre os dois grupos 19 . Como o enriquecimento da microbiota pulmonar com táxons da cavidade oral está associado ao aumento da inflamação em fumantes 75, é plausível que as alterações na microbiota oral e a falha em eliminar efetivamente os microrganismos aspirados contribuam para o desenvolvimento da doença e podem ajudar a explicar por que apenas um subconjunto de fumantes desenvolve DPOC. Além disso, existem diferenças substanciais entre a microbiota pulmonar de pacientes com DPOC em comparação com fumantes 'saudáveis' 76 , 77 , o que levou à proposta de que a microbiota respiratória pode ser útil no diagnóstico precoce da DPOC. Em contraste, nenhum estudo até o momento investigou mudanças na microbiota intestinal de pacientes com DPOC. No entanto, em fumantes 'saudáveis', a microbiota fecal é caracterizada por um aumento na abundância de Bacteroides-Prevotella 78 e uma diminuição da razão Firmicutes / Bacteroidetes 79em comparação com não fumantes. Essas mudanças na composição da microbiota fecal foram associadas à inflamação intestinal e IBD 80 , 81 . Os fumantes também apresentam diminuição da abundância de Bifidobacterium spp. 79 , 82 e, portanto, pode perder os efeitos antiinflamatórios que costumam estar associados a esse gênero.
As causas das alterações associadas ao fumo na composição da microbiota intestinal são provavelmente uma combinação de alterações ambientais, do hospedeiro e microbianas, como distúrbio intestinal e imunológico, eliminação prejudicada de patógenos 83 , 84 , acidificação do conteúdo gástrico 85 e ingestão de bactérias que estão presentes nos cigarros 86 . Além disso, a fumaça do cigarro pode afetar diretamente a virulência de bactérias 87 e fungos 88 , bem como alterar o crescimento e a estrutura de exopolissacarídeos de bactérias intestinais conhecidas, como Bifidobacterium animalis 89, o que pode contribuir para a disbiose. Mesmo após a cessação do tabagismo, muitas das alterações que causam disbiose persistem por períodos prolongados de tempo e, portanto, qualquer intervenção terapêutica para restaurar a microbiota intestinal pode exigir administração repetida para prevenir recaídas.
Na ausência de estudos longitudinais ou de intervenção, é difícil determinar se as alterações no intestino ou na microbiota respiratória são uma causa ou consequência da DPOC. Muito provavelmente, ambos são verdadeiros e operam simultaneamente ou em diferentes estágios da doença. A exposição a estímulos ambientais e o aparecimento da doença causam disbiose, que, por sua vez, provavelmente contribui para a progressão da doença. Além disso, o uso definido de probióticos pode beneficiar pacientes com DPOC, particularmente se usado como uma intervenção preventiva precoce. A administração oral de Lactobacillus casei melhorou a função anteriormente defeituosa das células assassinas naturais periféricas em fumantes adultos do sexo masculino 90 , enquanto Bifidobacterium breve e Lactobacillus rhamnosusredução da patologia pulmonar em um modelo de camundongo de DPOC 91 e redução das respostas inflamatórias em macrófagos que foram expostos ao extrato da fumaça do cigarro in vitro 92 . Da mesma forma, uma dieta que aumenta a produção de SCFAs protege contra inflamação induzida por elastase e enfisema 93 . Embora uma relação causal entre os SCFAs e a proteção neste estudo não tenha sido confirmada, tanto a fumaça do cigarro 94 quanto as partículas ambientais 95 diminuíram as concentrações de SCFA em roedores, e o condensado da fumaça do cigarro diminuiu a produção de SCFAs in vitro 89. Além disso, o aumento da translocação intestinal de bactérias e seus produtos ocorreu após a exposição a partículas ou o desenvolvimento de DPOC 2 , 95 , 96 . Toxinas bacterianas, como a enterotoxina 97 ou LPS 98 , podem contribuir para a patogênese da DPOC e a inflamação intestinal associada à microbiota pode se tornar sistêmica e também contribuir. O potencial dos SCFAs para melhorar a função da barreira intestinal pode ser responsável por seus benefícios em modelos animais de DPOC 99 , 100 , embora isso ainda deva ser explorado em estudos clínicos.
Infecções respiratórias. A microbiota intestinal é amplamente protetora contra a infecção respiratória, pois seu esgotamento ou ausência em camundongos leva a respostas imunológicas prejudicadas e piora os resultados após infecção respiratória bacteriana ou viral 34 , 41 , 101 , 102 , 103 . A administração de SFB melhorou a resistência a Staphylococcus aureus pneumonia 43 e Bifidobacterium spp. protegido contrainfecção pulmonarbacteriana 104 e viral em camundongos 103 , 105 . Lactobacillus spp. e Bifidobacteriumos probióticos baseados em spp. também melhoraram a incidência e os resultados de infecções respiratórias em humanos 106 , 107 , 108 , 109 .
Vários aspectos do desenho experimental influenciam os resultados dos estudos de infecção, incluindo a via de administração dos ligantes bacterianos 102 , 110 , a instalação de origem dos animais de pesquisa 43 , o tipo de antibiótico usado para o esgotamento da microbiota 62 , 102 e o infectando o patógeno. Por exemplo, o vírus herpes simplex tipo 2 ou Legionella pneumophila não parecem ser influenciados pela depleção da microbiota mediada por antibióticos 102 .
No entanto, vários mecanismos importantes pelos quais a microbiota intestinal promove a eliminação de patógenos foram identificados. As respostas imunes inatas às bactérias nos pulmões são grandemente aumentadas pela exposição ao receptor semelhante ao domínio de oligomerização de ligação de nucleotídeos (NOD) e agonistas de TLR no GIT, que incluem peptidoglicano, LPS, ácido lipoteicóico e DNA CpG 41 , 101 , 110 . Da mesma forma, a estimulação de TLRs por componentes da parede celular e flagelina de bactérias intestinais é necessária para respostas imunes adaptativas eficazes à influenza 102 , 111 , enquanto os efeitos antiinflamatórios da administração oral de SCFA estão ligados à redução da patologia pulmonar após ambas as bactérias 104 , 112e infecção viral 113 em camundongos. No entanto, a microbiota também pode conduzir a patologia intestinal na infecção pulmonar. A infecção pelo vírus da gripe em camundongos aumentou o número de células T CD4 + positivas para receptor 9 de CC-quimiocina derivadas do pulmão (CCR9 + ) , que migram preferencialmente para o GIT sob a orientação do ligante de motivo CC 25 (CCL25) expresso em células epiteliais intestinais 114 . Isso resultou no crescimento de E. coli e na indução de respostas aberrantes de T H 17 e dano intestinal.
Conclusões e perspectivas
Muitos estudos identificaram a presença de uma microbiota pulmonar na saúde e na doença. No entanto, acreditamos que a microbiota pulmonar saudável pode ser transitória e melhor descrita como uma progressão de taxa que é influenciada por locais adjacentes do corpo e o ambiente externo, em vez de uma comunidade residente central de reprodução ativa. Isso não está subestimando a importância de uma microbiota transitória em pulmões saudáveis, que ainda poderia ter papéis importantes nas respostas inflamatórias, viáveis ou não. Em contraste, a microbiota tem maior probabilidade de ser persistente e residente no trato respiratório e nos pulmões de indivíduos com doença respiratória, embora se ela seja uma causa ou consequência da doença ainda não tenha sido elucidado. Além disso, a microbiota pulmonar pode afetar ou ser afetada por microrganismos ou respostas imunológicas em locais distais.
A conversa cruzada entre os microrganismos e o hospedeiro é complexa e nossa compreensão atual dessas interações está em sua infância. É improvável que qualquer uma dessas interações seja a única responsável pelas funções da microbiota, e alterações em qualquer parte dessas relações podem ser suficientes para afetar a saúde e a doença. Não está claro se as mudanças na microbiota em um local afetam muitos locais distais igualmente, ou se esses efeitos sistêmicos podem ser específicos para certos tecidos. Até o momento, nenhum estudo tão amplo investigando esses efeitos sistêmicos generalizados foi realizado.
Até agora, os estudos da microbiota intestinal e pulmonar tiveram duas limitações principais: a primeira é discernir os efeitos causais em relação aos correlativos e a segunda é o tempo. A maioria dos estudos foi associativa. Além disso, a identificação independente de cultura de microrganismos ainda não substituiu a necessidade de isolar e cultivar patógenos oportunistas suspeitos ou probióticos para estudar seus efeitos, e muitos membros da microbiota não podem ser facilmente cultivados. Assim, normalmente não está claro se as alterações observadas na microbiota são a causa ou o efeito da doença. No caso do tempo, a maioria dos dados experimentais descreveu o efeito da microbiota intestinal no desenvolvimento da doença pulmonar e não na doença pulmonar estabelecida. São necessários estudos longitudinais em humanos e animais que associem alterações na microbiota com a gravidade da doença pulmonar crônica estabelecida. A pesquisa sobre as manipulações da microbiota durante a doença pulmonar é necessária para melhorar nossa compreensão e informar o desenvolvimento de novas terapias (Caixa 2 ).
Cada vez mais, a pesquisa da microbiota está se movendo no sentido de definir guildas funcionais. Como a variação taxonômica entre locais e indivíduos é tão grande, e a microbiota consiste em milhares de espécies, é altamente provável que haja redundância entre as espécies em termos de suas interações com outros microrganismos e nos metabólitos que produzem. Assim, as abordagens 'ômicas' da próxima geração são necessárias para identificar guildas funcionais para ajudar a definir como a microbiota do intestino e a microbiota dos pulmões interagem entre si e influenciam a saúde e a doença.
Em resumo, a microbiota pulmonar em um indivíduo saudável pode ser transitória e constantemente semeada do meio ambiente e eliminada pelo sistema imunológico, mas ainda pode influenciar a saúde e a doença. Nas doenças respiratórias, a microbiota pulmonar provavelmente se torna persistente e pode ser tanto causa quanto consequência da doença, formando uma alça de feedback patogênica. Está claro que componentes e metabólitos bacterianos no intestino e nos pulmões têm capacidade de modular a imunidade sistêmica e local, com táxons específicos capazes de influenciar a patogênese de doenças respiratórias, como asma, DPOC e infecções respiratórias. Essas relações foram identificadas em outras doenças respiratórias, como a fibrose cística 115, que, como doença genética, é um caso especial. Desafios respiratórios com fatores ambientais, como poluição, fumaça de cigarro, antibióticos e dieta, influenciam o risco de doenças e provavelmente impulsionam a patogênese por meio de sua capacidade de modular a composição da microbiota, embora os mecanismos desses efeitos permaneçam desconhecidos. Outros estudos longitudinais e experimentos intervencionistas aprimorados ajudarão a elucidar o papel da microbiota e da crosstalk intestinal / pulmonar nas doenças respiratórias e potencialmente levarão à identificação de novos e eficazes caminhos para o tratamento.
Referências
- 1
Roussos, A., Koursarakos, P., Patsopoulos, D., Gerogianni, I. & Philippou, N. Aumento da prevalência da síndrome do intestino irritável em pacientes com asma brônquica. Respir. Med. 97 , 75–79 (2003).
- 2
Rutten, EP, Lenaerts, K., Buurman, WA & Wouters, EF Integridade intestinal perturbada em pacientes com DPOC: efeitos das atividades da vida diária. Chest 145 , 245-252 (2014).
- 3
Yazar, A. et al. Sintomas respiratórios e alterações funcionais pulmonares em pacientes com síndrome do intestino irritável. Sou. J. Gastroenterol. 96 , 1511–1516 (2001).
- 4
Keely, S., Talley, NJ & Hansbro, PM Discurso cruzado pulmonar-intestinal na doença inflamatória da mucosa. Mucosal Immunol. 5 , 7-18 (2012).
- 5
Vieira, WA & Pretorius, E. O impacto da asma no trato gastrointestinal (TGI). J. Asthma Allergy 3 , 123-130 (2010).
- 6
Wymore Brand, M. et al. A flora Schaedler alterada: aplicações contínuas de uma comunidade microbiana murina definida. ILAR J. 56 , 169-178 (2015).
- 7
Al-Asmakh, M. & Zadjali, F. Use of germ-free animal models in microbiota-related research. J. Microbiol. Biotechnol. 25 , 1583–1588 (2015).
- 8
Quercia, S. et al. Da vida à evolução: escalas de tempo da adaptação da microbiota intestinal humana. Frente. Microbiol. 5 , 587 (2014).
- 9
Noverr, MC, Falkowski, NR, McDonald, RA, McKenzie, AN & Huffnagle, GB Desenvolvimento de doença alérgica das vias aéreas em camundongos após terapia com antibióticos e aumento da microbiota fúngica: papel da genética do hospedeiro, antígeno e interleucina-13. Infectar. Immun. 73 , 30–38 (2005).
- 10
Russell, SL et al. Mudanças na microbiota causadas por antibióticos no início da vida aumentam a suscetibilidade à asma alérgica. EMBO Rep. 13 , 440–447 (2012).
- 11
Russell, SL et al. Mudanças induzidas por antibióticos perinatais na microbiota intestinal têm efeitos diferenciais nas doenças pulmonares inflamatórias. J. Allergy Clin. Immunol. 135 , 100–109 (2015).
- 12
Arrieta, M. et al. Alterações microbianas e metabólicas na primeira infância afetam o risco de asma infantil. Sci. Tradução Med. 7 , 307ra152 (2015).
- 13
Aguirre de Carcer, D. et al. A ecologia numérica valida uma distribuição biogeográfica e um efeito baseado no gênero nas bactérias associadas à mucosa ao longo do cólon humano. ISME J. 5 , 801–809 (2011).
- 14
Donaldson, GP, Lee, SM & Mazmanian, SK Gut biogeography of the bacterial microbiota. Nat. Rev. Microbiol. 14 , 20–32 (2016).
- 15
Buffie, CG & Pamer, EG Resistência à colonização mediada por microbiota contra patógenos intestinais. Nat. Rev. Immunol. 13 , 790–801 (2013).
- 16
Zhernakova, A. et al. A análise metagenômica baseada na população revela marcadores para a composição e diversidade do microbioma intestinal. Science 352 , 565–569 (2016).
- 17
Qin, J. et al. Catálogo de genes microbianos do intestino humano estabelecido por sequenciamento metagenômico. Nature 464 , 59–65 (2010).
- 18
Ormerod, KL et al. Caracterização genômica da família Bacteroidales S24-7 não cultivada que habita o intestino de animais homeotérmicos. Microbiome 4 , 36 (2016).
- 19
Morris, A. et al. Comparação do microbioma respiratório em não fumantes e fumantes saudáveis. Sou. J. Respir. Crit. Care Med. 187 , 1067–1075 (2013).
- 20
Bassis, CM et al. Análise das microbiotas do trato respiratório superior como fonte do pulmão e microbiotas gástricas em indivíduos saudáveis. mBio 6 , e00037 (2015).
- 21
Segal, LN et al. O enriquecimento do microbioma pulmonar com taxa oral está associado à inflamação pulmonar de um fenótipo TH17. Nat. Microbiol. 1 , 16031 (2016).
- 22
Rogers, GB et al. Avaliação da importância diagnóstica de células bacterianas inviáveis em infecções respiratórias. Diagn. Microbiol. Infectar. Dis. 62 , 133–141 (2008).
- 23
Shanahan, ER, Zhong, L., Talley, NJ, Morrison, M. & Holtmann, G. Caracterização da microbiota associada à mucosa gastrointestinal: uma nova técnica para prevenir a contaminação cruzada durante procedimentos endoscópicos. Aliment. Pharmacol. Ther. 43 , 1186–1196 (2016).
- 24
Pope, PB et al. Isolamento de Succinivibrionaceae implicado em baixas emissões de metano de wallabies Tammar. Science 333 , 646-648 (2011).
- 25
Neish, AS et al. Regulação procariótica de respostas epiteliais pela inibição da ubiquitinação de IκB-α. Science 289 , 1560–1563 (2000).
- 26
Atarashi, K. et al. Indução de Treg por uma mistura racionalmente selecionada de cepas de Clostridia da microbiota humana. Nature 500 , 232-236 (2013).
- 27
Ratner, AJ, Lysenko, ES, Paul, MN & Weiser, JN Synergistic pró-inflamatórias respostas induzidas por polimicrobiana colonização de superfícies epiteliais. Proc. Natl Acad. Sci. USA 102 , 3429–3434 (2005).
- 28
Preston, JA et al. Inibição de doença alérgica das vias respiratórias por terapia imunomoduladora com Streptococcus pneumoniae inteiro morto . Vaccine 25 , 8154–8162 (2007).
- 29
Thorburn, AN, Foster, PS, Gibson, PG & Hansbro, PM Componentes de Streptococcus pneumoniae suprimem doenças alérgicas das vias aéreas e células NKT induzindo células T reguladoras. J. Immunol. 188 , 4611–4620 (2012).
- 30
Thorburn, AN & Hansbro, PM Aproveitando as células T regulatórias para suprimir a asma: do potencial à terapia. Sou. J. Respir. Cell Mol. Biol. 43 , 511–519 (2010).
- 31
Preston, JA et al. A infecção por Streptococcus pneumoniae suprime a doença alérgica das vias aéreas por meio da indução de células T regulatórias. EUR. Respir. J. 37 , 53–64 (2011).
- 32
Bernasconi, E. et al. A microbiota das vias aéreas determina os perfis inatos de células inflamatórias ou de remodelação tecidual no transplante de pulmão. Sou. J. Respir. Crit. Care Med. http://dx.doi.org/10.1164/rccm.201512-2424OC (2016).
- 33
Larsen, JM et al. Doença pulmonar obstrutiva crônica e Proteobacteria associada à asma, mas não Prevotella spp. Comensal , promovem inflamação e patologia pulmonar independente do receptor 2 do tipo Toll. Immunology 144 , 333-342 (2015).
- 34
Schuijt, TJ et al. A microbiota intestinal desempenha um papel protetor na defesa do hospedeiro contra a pneumonia pneumocócica. Gut 65 , 575–583 (2016).
- 35
Dickson, RP & Cox, MJ A invocação prematura de um 'eixo intestino-pulmão' pode obscurecer os efeitos diretos da microbiota respiratória na suscetibilidade à pneumonia. Gut http://dx.doi.org/10.1136/gutjnl-2016-311823 (2016).
- 36
van Nimwegen, FA et al. Modo e local de parto, microbiota gastrointestinal e sua influência na asma e atopia. J. Allergy Clin. Immunol. 128 , 948–955 (2011).
- 37
Akay, HK et al. A relação entre bifidobactérias e asma alérgica e / ou dermatite alérgica: um estudo prospectivo com crianças de 0 a 3 anos na Turquia. Anaerobe 28 , 98–103 (2014).
- 38
Marsland, BJ, Trompette, A. & Gollwitzer, ES O eixo intestino-pulmão em doenças respiratórias. Ann. Sou. Thorac. Soc. 12 (Suplemento 2), S150 – S156 (2015).
- 39
Trompette, A. et al. O metabolismo da fibra alimentar da microbiota intestinal influencia as doenças alérgicas das vias aéreas e a hematopoiese. Nat. Med. 20 , 159-166 (2014).
- 40
Dickson, RP et al. Enriquecimento do microbioma pulmonar com bactérias intestinais na sepse e na síndrome do desconforto respiratório agudo. Nat. Microbiol. 1 , 16113 (2016).
- 41
Fagundes, CT et al. A ativação transitória de TLR restaura a resposta inflamatória e a capacidade de controlar a infecção bacteriana pulmonar em camundongos livres de germes. J. Immunol. 188 , 1411–1420 (2012).
- 42
Olszak, T. et al. A exposição microbiana durante o início da vida tem efeitos persistentes na função das células T assassinas naturais. Science 336 , 489-493 (2012).
- 43
Gauguet, S. et al. A microbiota intestinal de camundongos influencia a resistência à pneumonia por Staphylococcus aureus . Infectar. Immun. 83 , 4003–4014 (2015).
- 44
Fujimura, KE et al. A exposição à poeira doméstica medeia o enriquecimento de Lactobacillus do microbioma intestinal e a defesa imunológica das vias aéreas contra alérgenos e infecções por vírus. Proc. Natl Acad. Sci. USA 111 , 805–810 (2014).
- 45
Samuelson, DR, Welsh, DA & Shellito, JE Regulamento da imunidade pulmonar e defesa do hospedeiro pela microbiota intestinal. Frente. Microbiol. 6 , 1085 (2015).
- 46
Chen, Y. & Blaser, MJ associações inversas de Helicobacter pylori com asma e alergia. Arco. Intern. Med. 167 , 821–827 (2007).
- 47
Reibman, J. et al. A asma está inversamente associada ao status do Helicobacter pylori em uma população urbana. PLoS ONE 3 , e4060 (2008).
- 48
Chen, Y. & Blaser, MJ A colonização do Helicobacter pylori está inversamente associada à asma infantil. J. Infect. Dis. 198 , 553–560 (2008).
- 49
Wang, F., Liu, J., Zhang, Y. & Lei, P. Associação de infecção por Helicobacter pylori com doença pulmonar obstrutiva crônica e bronquite crônica: uma meta-análise de 16 estudos. Infectar. Dis. (Lond.) 47 , 597–603 (2015).
- 50
Hussain, K. et al. A proteção contra alergia mediada por Helicobacter pylori está associada a células T reguladoras do sangue periférico secretoras de IL-10. Frente. Immunol. 7 , 71 (2016).
- 51
McGhee, JR et al. Regulação de lipopolissacarídeo (LPS) da resposta imune: os linfócitos T de camundongos normais suprimem as respostas mitogênicas e imunogênicas ao LPS. J. Immunol. 124 , 1603–1611 (1980).
- 52
Michalek, SM, Kiyono, H., Wannemuehler, MJ, Mosteller, LM & McGhee, JR Lipopolissacarídeo (LPS) regulação da resposta imune: influência do LPS na indução de tolerância oral. J. Immunol. 128 , 1992-1998 (1982).
- 53
Ueda, Y. et al. A microbiota comensal induz hiporresponsividade ao LPS em macrófagos do cólon por meio da produção de IL-10. Int. Immunol. 22 , 953–962 (2010).
- 54
Mazmanian, SK, Round, JL & Kasper, DL Um fator de simbiose microbiano previne doenças inflamatórias intestinais. Nature 453 , 620-625 (2008).
- 55
Sharon, G. et al. Metabólitos especializados do microbioma em saúde e doença. Cell Metab. 20 , 719–730 (2014).
- 56
den Besten, G. et al. O papel dos ácidos graxos de cadeia curta na interação entre dieta, microbiota intestinal e metabolismo energético do hospedeiro. J. Lipid Res. 54 , 2325–2340 (2013).
- 57
Thorburn, AN et al. Evidências de que a asma é uma doença de origem do desenvolvimento influenciada pela dieta materna e metabólitos bacterianos. Nat. Comum. 6 , 7320 (2015).
- 58
Vatanen, T. et al. A variação na imunogenicidade do LPS do microbioma contribui para a autoimunidade em humanos. Cell 165 , 842–853 (2016).
- 59
Abrahamsson, TR et al. A diversidade da microbiota intestinal baixa na primeira infância precede a asma na idade escolar. Clin. Exp. Allergy 44 , 842–850 (2014).
- 60
Vael, C., Nelen, V., Verhulst, SL, Goossens, H. & Desager, KN Early intestinal Bacteroides fragilis colonization and development of asma. BMC Pulm. Med. 8 , 19 (2008).
- 61
Orivuori, L. et al. Alto nível de calprotectina fecal aos 2 meses de idade como marcador de inflamação intestinal prediz dermatite atópica e asma aos 6 anos de idade. Clin. Exp. Allergy 45 , 928–939 (2015).
- 62
Russell, SL et al. O tratamento com antibióticos perinatais afeta a microbiota murina, as respostas imunológicas e a asma alérgica. Gut Microbes 4 , 158-164 (2013).
- 63
Hevia, A. et al. Os pacientes alérgicos com asma crónica apresentam níveis baixos de Bifidobacterium adolescentis . PLoS ONE 11 , e0147809 (2016).
- 64
Hua, X., Goedert, JJ, Pu, A., Yu, G. & Shi, J. Associações de alergia com a microbiota fecal adulta: análise do American Gut Project. EBioMedicine 3 , 172-179 (2016).
- 65
He, F. et al. Estimulação da secreção de citocinas pró-inflamatórias por cepas de Bifidobacterium . Microbiol. Immunol. 46 , 781–785 (2002).
- 66
Johnson, JL, Jones, MB & Cobb, BA O polissacarídeo capsular bacteriano previne o início da asma por meio da ativação das células T. Glycobiology 25 , 368-375 (2015).
- 67
Sehrawat, A., Sinha, S. & Saxena, A. Helicobacter pylori proteína ativadora de neutrófilos: um potencial modulador de Treg na supressão da asma alérgica. Frente. Microbiol. 6 , 493 (2015).
- 68
Koch, KN et al. A ativação do eixo TLR2 / NLRP3 / IL-18 induzida pela urease do Helicobacter protege contra a asma. J. Clin. Investir. 125 , 3297–3302 (2015).
- 69
Engler, DB et al. O tratamento eficaz da inflamação alérgica das vias aéreas com imunomoduladores para Helicobacter pylori requer células dendríticas dependentes de BATF3 e IL-10. Proc. Natl Acad. Sci. USA 111 , 11810–11815 (2014).
- 70
Kim, YG et al. A disbiose intestinal promove a polarização do macrófago M2 e a inflamação alérgica das vias aéreas via PGE induzida por fungos (2). Cell Host Microbe 15 , 95–102 (2014).
- 71
Zaiss, MM et al. A microbiota intestinal contribui para a capacidade dos helmintos de modular a inflamação alérgica. Immunity 45 , 998–1010 (2015).
- 72
Furusawa, Y. et al. O butirato derivado de micróbio comensal induz a diferenciação de células T reguladoras do cólon. Nature 504 , 446–450 (2013).
- 73
Huang, F. et al. A exposição precoce ao Clostridium leptum causa imunossupressão pulmonar. PLoS ONE 10 , e0141717 (2015).
- 74
Li, YN et al. Efeito da alimentação oral com Clostridium leptum nas respostas regulatórias das células T e na inflamação alérgica das vias aéreas em camundongos. Ann. Allergy Asthma Immunol. 109 , 201–207 (2012).
- 75
Segal, LN et al. O enriquecimento do microbioma pulmonar com taxa supraglótica está associado ao aumento da inflamação pulmonar. Microbiome 1 , 19 (2013).
- 76
Pragman, AA, Kim, HB, Reilly, CS, Wendt, C. & Isaacson, RE O microbioma pulmonar na doença pulmonar obstrutiva crônica moderada e grave. PLoS ONE 7 , e47305 (2012).
- 77
Sze, MA et al. O microbioma do tecido pulmonar na doença pulmonar obstrutiva crônica. Sou. J. Respir. Crit. Care Med. 185 , 1073–1080 (2012).
- 78
Benjamin, JL et al. Fumantes com doença de Crohn ativa têm disbiose clinicamente relevante da microbiota gastrointestinal. Inflamação. Bowel Dis. 18 , 1092–1100 (2012).
- 79
Biedermann, L. et al. A cessação do tabagismo altera a microbiota intestinal: insights de investigações quantitativas em amostras fecais humanas. Inflamação. Bowel Dis. 20 , 1496-1501 (2014).
- 80
Kabeerdoss, J., Jayakanthan, P., Pugazhendhi, S. & Ramakrishna, BS Alterações da microbiota da mucosa no cólon de pacientes com doença inflamatória intestinal revelada pela amplificação em tempo real da reação em cadeia da polimerase do ácido ribonucleico ribossômico 16S. Indian J. Med. Res. 142 , 23–32 (2015).
- 81
Schwab, C. et al. Estudo longitudinal da atividade da microbiota murina e interações com o hospedeiro durante a inflamação aguda e recuperação. ISME J. 8 , 1101-1114 (2014).
- 82
Khonsari, S. et al. Um estudo comparativo de bifidobactérias em bebês humanos e adultos. Biosci. Microbiota Food Health 35 , 97–103 (2016).
- 83
Verschuere, S. et al. O tabagismo altera a apoptose epitelial e a composição imunológica em GALT murino. Lab. Investir. 91 , 1056–1067 (2011).
- 84
Allais, L. et al. A exposição crônica à fumaça do cigarro induz alterações microbianas e inflamatórias e alterações da mucina no intestino murino. Environ. Microbiol. 18 , 1352–1363 (2015).
- 85
Hammadi, M., Adi, M., John, R., Khoder, GA & Karam, SM Dysregulation of gástrico H, K-ATPase por extrato de fumaça de cigarro. World J. Gastroenterol. 15 , 4016–4022 (2009).
- 86
Sapkota, AR, Berger, S. & Vogel, TM Patógenos humanos abundantes no metagenoma bacteriano de cigarros. Environ. Perspectiva de saúde. 118 , 351–356 (2010).
- 87
Kulkarni, R. et al. A fumaça do cigarro aumenta a formação de biofilme de Staphylococcus aureus por meio do estresse oxidativo. Intect Immun. 80 , 3804–3811 (2012).
- 88
Semlali, A., Killer, K., Alanazi, H., Chmielewski, W. & Rouabhia, M. O condensado da fumaça do cigarro aumenta a adesão, crescimento, formação de biofilme de C. albicans e expressão dos genes EAP1 , HWP1 e SAP2 . BMC Microbiol. 14 , 61 (2014).
- 89
Hu, J., Wei, T., Sun, S., Zhao, A. & Xu, C. Efeitos do condensado da fumaça do cigarro na produção e caracterização de exopolissacarídeos por Bifidobacterium . Um. Acad. Bras. Cienc. 87 , 997–1005 (2015).
- 90
Reale, M. et al. A ingestão diária de Lactobacillus casei Shirota aumenta a atividade das células assassinas naturais em fumantes. Br. J. Nutr. 108 , 308–314 (2012).
- 91
Verheijden, KAT et al. O tratamento com prebióticos ou probióticos específicos previne o desenvolvimento de enfisema pulmonar em um modelo de camundongo com DPOC. EUR. J. Pharmacol. 668 , e12-e13 (2011).
- 92
Mortaz, E. et al. Efeitos antiinflamatórios de Lactobacillus rahmnosus e Bifidobacterium breve em macrófagos humanos ativados pela fumaça de cigarro. PLoS ONE 10 , e0136455 (2015).
- 93
Tomoda, K. et al. A dieta enteral à base de peptídeo de soro de leite atenuou o enfisema induzido por elastase com aumento de ácidos graxos de cadeia curta em camundongos. BMC Pulm. Med. 15 , 64 (2015).
- 94
Tomoda, K. et al. A fumaça do cigarro diminui os níveis de ácidos orgânicos e a população de Bifidobacterium no ceco de ratos. J. Toxicol. Sci. 36 , 261–266 (2011).
- 95
Kish, L. et al. O material particulado ambiental induz respostas inflamatórias intestinais murinas e altera o microbioma intestinal. PLoS ONE 8 , e62220 (2013).
- 96
Zuo, L. et al. O tabagismo está associado à disfunção da barreira intestinal no intestino delgado, mas não no intestino grosso de camundongos. J. Crohns Colitis 8 , 1710-1722 (2014).
- 97
Huvenne, W. et al. Exacerbação da inflamação pulmonar induzida pela fumaça do cigarro pela enterotoxina de Staphylococcus aureus em camundongos. Respir. Res. 12 , 69 (2011).
- 98
Brass, DM et al. A inalação crônica de LPS causa alterações do tipo enfisema no pulmão do camundongo, que estão associadas à apoptose. Sou. J. Respir. Célula. Mol. Biol. 39 , 584–590 (2008).
- 99
Kelly, CJ et al. A conversa cruzada entre os ácidos graxos de cadeia curta derivados da microbiota e o HIF epitelial intestinal aumenta a função de barreira do tecido. Cell Host Microbe 17 , 662–671 (2015).
- 100
Suzuki, T., Yoshida, S. & Hara, H. As concentrações fisiológicas de ácidos graxos de cadeia curta suprimem imediatamente a permeabilidade epitelial do cólon. Br. J. Nutr. 100 , 297-305 (2008).
- 101
Chen, LW, Chen, PH & Hsu, CM Microflora comensal contribui para a defesa do hospedeiro contra a pneumonia por Escherichia coli por meio de receptores toll-like. Shock 36 , 67–75 (2011).
- 102
Ichinohe, T. et al. A microbiota regula a defesa imunológica contra a infecção pelo vírus influenza A do trato respiratório. Proc. Natl Acad. Sci. USA 108 , 5354–5359 (2011).
- 103
Wu, S. et al. A microbiota regula a via de sinalização TLR7 contra a infecção pelo vírus influenza A do trato respiratório. Curr. Microbiol. 67 , 414–422 (2013).
- 104
Vieira, AT et al. Controle da infecção pulmonar por Klebsiella pneumoniae e imunomodulação por tratamento oral com probiótico comensal Bifidobacterium longum 5 1A . Microbes Infect. 18 , 180–189 (2016).
- 105
Kawahara, T. et al. A administração oral consecutiva de Bifidobacterium longum MM-2 melhora o sistema de defesa contra a infecção pelo vírus influenza, aumentando a atividade da célula natural killer em um modelo murino. Microbiol. Immunol. 59 , 1-12 (2015).
- 106
Luoto, R. et al. Suplementação com prebióticos e probióticos previne infecções por rinovírus em bebês prematuros: um ensaio randomizado controlado por placebo. J. Allergy Clin. Immunol. 133 , 405–413 (2014).
- 107
Jespersen, L. et al. Efeito de Lactobacillus paracasei subsp. paracasei , L. casei 431 na resposta imune à vacinação contra influenza e infecções do trato respiratório superior em voluntários adultos saudáveis: um estudo randomizado, duplo-cego, controlado por placebo, de grupos paralelos. Sou. J. Clin. Nutr. 101 , 1188–1196 (2015).
- 108
King, S., Glanville, J., Sanders, ME, Fitzgerald, A. & Varley, D. Eficácia dos probióticos na duração da doença em crianças e adultos saudáveis que desenvolvem doenças infecciosas respiratórias agudas comuns: uma revisão sistemática e meta- análise. Br. J. Nutr. 112 , 41–54 (2014).
- 109
West, NP et al. Suplementação de probióticos para sintomas de doenças respiratórias e gastrointestinais em indivíduos saudáveis fisicamente ativos. Clin. Nutr. 33 , 581–587 (2014).
- 110
Clarke, TB A imunidade inata precoce à infecção bacteriana no pulmão é regulada sistemicamente pela microbiota comensal por meio de ligantes de receptor semelhantes a Nod. Infectar. Immun. 82 , 4596-4606 (2014).
- 111
Oh, KZ et al. A detecção da microbiota intestinal mediada por TLR5 é necessária para respostas de anticorpos à vacinação contra influenza sazonal. Immunity 41 , 478-492 (2014).
- 112
Bernard, H. et al. Os oligossacarídeos ácidos derivados da pectina na dieta melhoram a depuração bacteriana pulmonar da infecção pulmonar por Pseudomonas aeruginosa em camundongos por meio da modulação da microbiota intestinal e da imunidade. J. Infect. Dis. 211 , 156–165 (2015).
- 113
Kishino, E., Takemura, N., Masaki, H., Ito, T. & Nakazawa, M. Dietary lactosucrose suprime a infecção pelo vírus influenza A (H1N1) em camundongos. Biosci. Microbiota Food Health 34 , 67–76 (2015).
- 114
Wang, J. et al. A infecção respiratória do vírus influenza induz lesão imunológica intestinal por meio de inflamação dependente de células TH17 mediada por microbiota. J. Exp. Med. 211 , 2397–2410 (2014).
- 115
Huang, YJ & LiPuma, JJ The microbiome in cystic fibrosis. Clin. Chest Med. 37 , 59-67 (2016).
- 116
Strachan, DP Febre do feno, higiene e tamanho da família. BMJ 299 , 1259-1260 (1989).
- 117
Riedler, J. et al. Exposição à agricultura na primeira infância e desenvolvimento de asma e alergia: um estudo transversal. Lancet 358 , 1129-1133 (2001).
- 118
Ball, TM et al. Irmãos, freqüência à creche e risco de asma e chiado na infância. N. Engl. J. Med. 343 , 538–543 (2000).
- 119
Rook, GA, Martinelli, R. & Brunet, LR Respostas imunes inatas a micobactérias e a regulação negativa de respostas atópicas. Curr. Opiniões Allergy Clin. Immunol. 3 , 337-342 (2003).
- 120
Bieber, T. Atopic dermatitis. N. Engl. J. Med. 358 , 1483–1494 (2008).
- 121
Gale, EA A ascensão do diabetes tipo 1 na infância no século XX. Diabetes 51 , 3353-3361 (2002).
- 122
Alonso, A. & Hernan, MA Tendências temporais na incidência de esclerose múltipla: uma revisão sistemática. Neurology 71 , 129-135 (2008).
- 123
Consórcio do Projeto Microbioma Humano. Estrutura, função e diversidade do microbioma humano saudável. Nature 486 , 207–214 (2012).
- 124
Ottman, N., Smidt, H., de Vos, WM & Belzer, C. A função da nossa microbiota: quem está lá fora e o que eles fazem? Frente. Célula. Infectar. Microbiol. 2 , 104 (2012).
- 125
Okada, H., Kuhn, C., Feillet, H. & Bach, JF A 'hipótese de higiene' para doenças autoimunes e alérgicas: uma atualização. Clin. Exp. Immunol. 160 , 1–9 (2010).
- 126
Maizels, RM, McSorley, HJ & Smyth, DJ Helminths na hipótese da higiene: mais cedo ou mais tarde? Clin. Exp. Immunol. 177 , 38–46 (2014).
- 127
Sun, X., Fiala, JL & Lowery, D. Patent watch: modulando o microbioma humano com produtos bioterapêuticos vivos: paisagem de propriedade intelectual. Nat. Rev. Drug Discov. 15 , 224–225 (2016).
- 128
Brown, AJ et al. Propriedades farmacológicas dos agonistas ácidos N- tiazolilamida FFA2. Pharmacol. Res. Perspect. 3 , e00141 (2015).
- 129
Hudson, BD et al. Definição da base molecular para os primeiros agonistas ortostéricos potentes e seletivos do receptor de ácido graxo livre FFA2. J. Biol. Chem. 288 , 17296–17312 (2013).
- 130
Schmidt, J. et al. Agonistas seletivos do receptor 2 de ácidos graxos livres ortostéricos (FFA2): identificação dos requisitos estruturais e químicos para ativação seletiva de FFA2 versus FFA3. J. Biol. Chem. 286 , 10628–10640 (2011).
- 131
Maslowski, KM et al. Regulação de respostas inflamatórias pela microbiota intestinal e receptor quimioatraente GPR43. Nature 461 , 1282–1286 (2009).
Reconhecimentos
Os autores reconhecem o apoio de bolsas do Conselho Nacional de Saúde e Pesquisa Médica da Austrália (NHMRC; para MAC e PMH), Conselho de Pesquisa Australiano (ARC; para PH), Fundação Brawn, Faculdade de Saúde e Medicina da Universidade de Newcastle, Austrália, e doações do NHMRC e da Rainbow Foundation (para PMH). Os autores agradecem a F. Thomson e M. Thomson por seu apoio contínuo.
Informação sobre o autor
Afiliações
autor correspondente
Declarações de ética
Interesses competitivos
Os autores declaram não haver interesses financeiros concorrentes.
Direitos e permissões
Sobre este artigo
Cite este artigo
Budden, K., Gellatly, S., Wood, D. et al. Ligações patogênicas emergentes entre a microbiota e o eixo intestino-pulmão. Nat Rev Microbiol 15, 55–63 (2017). https://doi.org/10.1038/nrmicro.2016.142
Publicados
Data de emissão
Comentários
Postar um comentário