
Doença Celíaca: diretrizes diagnósticas da ESPGHAN 2020
Prof. Dr. Ulysses Fagundes Neto
O número de janeiro de 2020, da tradicional revista Journal of Pediatric Gastroenterology and Nutrition, traz um artigo intitulado “European Society Pediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) guidelines for diagnosing Celiac Disease 2020” de autoria de Husby S. e cols., devidamente revisadas, que abaixo passo a resumir.
Introdução
O reconhecimento do amplo espectro clínico da Doença Celíaca (DC) evoluiu durante as últimas décadas. Tornou-se evidente que a DC é uma enfermidade comum que ocorre em todas as idades e com uma grande variedade de sinais e sintomas. Em 2012 (2), um grupo de trabalho da ESPGHAN revisou as diretrizes diagnósticas para a DC. A principal mensagem destas orientações afirma que o diagnóstico da DC pode ser estabelecido sem a necessidade da realização de biópsias em um subgrupo de pacientes pediátricos, porque a enteropatia celíaca (alterações Marsh 2 ou 3) encontra-se praticamente de forma invariavelmente presente nos pacientes com níveis séricos altamente elevados para os auto anticorpos celíacos. Para esta abordagem, assim chamada não-biópsia, todos os seguintes critérios teriam que ser preenchidos:
- Sintomas sugestivos de DC (particularmente má absorção);
- Níveis séricos ≥10 vezes o limite da normalidade (ULN) dos anticorpos IgA antitransglutaminase (TGA-IgA);
- Anticorpos Antiendomisio (EMA-IgA) em uma segunda amostra sanguínea;
- Positividade do antígeno leucocitário humano (HLA) de risco para DC, alelos DQ2 e/ou DQ8;
- A não realização das biópsias duodenais deveria ser somente levada em consideração caso os pacientes/pais compreendessem este critério diagnóstico e estivessem comprometidos com a utilização de uma dieta isenta de glúten. O diagnóstico e o seguimento do paciente deveriam ser realizados por um Gastropediatra.
Muito embora as últimas diretrizes envolvendo pacientes adultos, publicadas em 2013 e 2014 (3-4), não tivessem dado a opção para a abordagem não-biópsia, as diretrizes da ESPGHAN 2012 atraíram grande interesse. Inúmeros estudos prospectivos recentes têm avaliado favoravelmente o desempenho não-biópsia e com base nesta evidência foi decidido atualizar e expandir as diretrizes de 2012 (4).
Métodos
Foram enviadas aos membros do grupo de trabalho 10 questões e as recomendações resultantes estão apresentadas na Tabela 1. A análise histológica das biópsias duodenais foi considerada como o padrão de referência na acurácia diagnóstica e os desfechos pré definidos de maior interesse foram: sensibilidade, especificidade e valores preditivos negativo e positivo.
Tabela 1- Questions for the 2020 European Society Paediatric Gastroenterology, Hepatology and Nutrition criteria for the diagnosis of coeliac disease

Tabela 1- Questions for the 2020 European Society Paediatric Gastroenterology, Hepatology and Nutrition criteria for the diagnosis of coeliac disease.
Resultados
Sintomas e Sinais
Questão 1: Há alguma diferença na prevalência da DC nas crianças com constipação, dor abdominal, sinais de Síndrome do Intestino Irritável (SII), dispepsia, má absorção, anemia ferropriva ou aftas orais, em comparação com a população geral?
Um largo espectro de sintomas e sinais têm sido relatados nos pacientes no momento do diagnóstico da DC. Sintomas clássicos de má absorção parecem ser mais específicos e incluem failure to thrive, perda de peso e diarreia crônica. Em relação aos sintomas menos específicos, há evidências de que pacientes com sintomas de SII com diarreia, anemia ferropriva, constipação crônica e defeito do esmalte dentário, apresentam um risco aumentado para a DC. Em relação a outros sintomas gastrointestinais inespecíficos tais como, dor abdominal, dispepsia e flatulência, as evidências são insuficientes.
O grupo de trabalho recomenda considerar o teste para a DC nas crianças e adolescentes cujos sintomas e sinais estão apresentados na Tabela 2.
Aspectos HLA
Questão 2: O que a pesquisa HLA QD2/DQ8 acrescenta para o diagnóstico de certeza da DC?
A tipagem HLA não acrescenta certeza no diagnóstico da DC, caso outros critérios sejam preenchidos. A pesquisa HLA DQ2/DQ8 pode ser útil em outras circunstâncias. Vale ressaltar, que caso destes alelos resultarem negativos, provavelmente o diagnóstico da DC está descartado.
O grupo de trabalho recomenda que a tipagem HLA não se faz necessária nos pacientes que apresentam TGA-IgA positivo, caso eles se qualifiquem para o diagnóstico da DC com a realização de biópsias, ou caso os títulos séricos TGA-IgA forem ≥10 vezes a unidade padrão, associados ao EMA-IgA positivo. Caso a pesquisa dos testes HLA DQ2/DQ8 resultem negativa, o risco para DC é muito baixo, e, por outro lado, um resultado positivo não confirma o diagnóstico.
Anticorpos
Questão 3: O algoritmo proposto para evitar biópsias em pacientes sintomáticos também se aplica a indivíduos assintomáticos?
Estudos recentes sugerem que a abordagem não-biópsia para o diagnóstico da DC pode ser aplicada para crianças assintomáticas. Entretanto, nas crianças assintomáticas, o valor preditivo positivo (vpp) dos níveis elevados TGA-IgA ≥10 vezes a unidade padrão pode ser mais baixo nas crianças assintomáticas, o que necessita ser considerado durante o processo de tomada de decisão.
O grupo de trabalho oferece uma recomendação condicional que, levando-se em consideração a evidência disponível, a DC pode ser diagnosticada sem a realização de biópsias duodenais em crianças assintomáticas utilizando-se os mesmos critérios que aqueles válidos para pacientes sintomáticos. O grupo de trabalho recomenda que a decisão de se realizar ou não biópsias duodenais para o diagnóstico da DC, deve ser tomada durante um processo de discussão compartilhada juntamente com os pais e se possível com a própria criança.
Questão 4: Qual é o teste sorológico mais apropriado para o diagnóstico da DC?
Os três anticorpos específicos para o diagnóstico de DC, a saber: TGA-IgA, EMA-IgA e DGP-IgG, apresentam diferentes desempenhos. TGA-IgA apresenta a mais alta pontuação quando se leva em consideração a acurácia do teste, em comparação com os outros dois, e, é portanto, considerado como o teste mais apropriado na bateria diagnóstica nas crianças com suspeita de DC. O grupo de trabalho recomenda que, em indivíduos que apresentam valores séricos normais de IgA para a idade, a TGA-IgA deve ser usada como teste inicial a despeito da idade.
Questão 5: Deve-se utilizar mais do que um teste sorológico, e, em caso positivo, qual deve ser a sequência da testagem?
A evidência atual indica que a adição dos testes DGP-IgG, DGP-IgA ou AGA-IgA em relação a TGA-IgA raramente aumenta a sensibilidade após a exclusão de pacientes com níveis baixos de IgA total. A especificidade nitidamente diminui, especialmente nas crianças menores de 4 anos de idade, nas quais a positividade isolada da DPG ou AGA é um fenômeno comum transitório.
O grupo de trabalho recomenda o teste para a realização da IgA sérica total e a TGA-IgA como rastreamento inicial nas crianças suspeitas de DC. Nos pacientes com níveis baixos de IgA sérica, um teste baseado na IgG (DGP, EMA ou TGA) deve ser realizado como um segundo passo. A testagem para anticorpos EMA, DGP ou AGA (IgG ou IgA) como um rastreamento inicial na prática clínica não está recomendado.
Questão 6: Qual o ponto de corte para a TGA-IgA (ULN ≥10x, 7x, 5x) pode ser estabelecido com segurança (valor preditivo positivo superior a 95%) para o diagnóstico da DC com omissão das biópsias?
Níveis séricos elevados de TGA-IgA ≥10x a ULN, prevê enteropatia Marsh 2 a 3, e devem ser utilizados como critério diagnóstico para a DC sem a realização de biópsias. Devido a variabilidade entre laboratórios e entre os testes, a confiabilidade dos níveis positivos de TGA-IgA menores que 10x a ULN é baixa, e como a TGA-IgG está mais inclinada para erros técnicos, estes critérios não são apropriados para a abordagem desprovida de biópsias.
O grupo de trabalho recomenda, para o diagnóstico da DC sem biópsias, a obrigatoriedade de que os níveis séricos da TGA-IgA ≥10x a ULN seja levada em consideração. Somente testes do anticorpo com o cálculo da curva utilizando um calibrador próprio e demonstrando o valor de ≥10x a ULN, dentro do seu alcance de mensuração deve ser utilizado. O grupo de trabalho manifesta-se ser contrário a omissão de biópsias nos casos de deficiência sérica de IgA, mesmo quando os testes sorológicos IgG mostrarem-se positivos.
Questão 7: A testagem do EMA-IgA faz-se necessária em todos os casos para o diagnóstico da DC sem biópsias?
Embora altos títulos TGA-IgA ≥10x a ULN sejam raros nas crianças com histologia duodenal normal, um resultado EMA-IgA positivo, posteriormente realizado, irá diminuir significativamente a taxa de resultados falso-positivos.
O grupo de trabalho recomenda que em crianças com TGA-IgA ≥10x a ULN, e com o consentimento dos pais/paciente para a abordagem não biópsias, o diagnóstico de DC de ser confirmado com um teste positivo EMA -IgA, em uma segunda amostra sanguínea.
Biópsia
Questão 8: Qual é a variabilidade inter e intra observadores a respeito do resultado histopatológico para o diagnóstico da DC nas biópsias duodenais e do bulbo? Qual o grau de lesão é considerado para DC não tratada? Biópsia do bulbo duodenal aumenta a taxa de detecção de DC? Faz-se necessária a referência de um patologista experimentado na prática clínica?
A variabilidade inter-observador, com relação a graduação das lesões histopatológicas do intestino delgado é elevada, o que indica que a histopatologia não pode ser utilizada como um único padrão de referência. Uma taxa mais alta de detecção da DC pode ser alcançada com múltiplas amostras duodenais, incluindo pelo menos uma do bulbo. A leitura histopatológica pode ser aperfeiçoada pela validação de procedimento operacionais padronizados. Biópsias de baixa qualidade ou com orientação incorreta não são apropriadas para o diagnóstico da DC.
O grupo de trabalho recomenda que sejam obtidas pelo menos 4 biópsias do duodeno distal e pelo menos uma do bulbo duodenal, para a avaliação histológica, na vigência de uma dieta contendo glúten. A leitura das biópsias deve ser realizada em material otimamente orientado. Uma relação vilosidade/cripta inferior a 2, indica lesão da mucosa. Nos casos de resultados discordantes entre a TGA-IgA e a histopatologia, novos cortes do material de biópsia e/ou uma segunda opinião emitida por um patologista experimentado, deve ser requerida.
Questão 9: Teria uma lesão Marsh 1 (somente aumento da contagem dos linfócitos intraepiteliais) em comparação com Marsh 0, um desfecho a longo prazo, diferente em relação ao diagnóstico da DC nas crianças com autoimunidade celíaca (TGA ou EMA positivos)?
O termo DC potencial identifica indivíduos com TGA-IgA e EMA-IgA positivos e isentas de mínimas alterações histológicas no intestino delgado. Motivos para esta situação, entretanto, podem também serem devidas a uma baixa ingestão de glúten, antes da realização das biópsias, erros de amostragem ou orientação incorreta das biópsias para leitura, acarretando um diagnóstico equivocado de DC potencial ao invés de DC verdadeira. Lesão Marsh1 não é considerada suficiente para o diagnóstico de DC, porém, alguns observadores sugerem que casos de DC potencial com lesões MArsh 1, têm uma probabilidade maior para evoluir para atrofia vilositária em comparação a Marsh 0.
O grupo de trabalho recomenda que, antes de se diagnosticar DC potencial, seja checado o conteúdo de glúten na dieta e a correta orientação das biópsias. Uma vez confirmado o diagnóstico de DC potencial é necessária uma vigilância clínica e laboratorial (sorologia e biópsias posteriores) para monitorar a possível evolução para atrofia vilositária. Para questões de seguimento é importante referir o paciente para um centro de cuidado terciário com expertise na DC.
Questão 10: Qual a frequência de outros diagnósticos clínicos relevantes serem perdidos, no caso de a endoscopia digestiva alta (EDA) (esofágica, gástrica e duodenal) não ser realizada naqueles pacientes diagnosticados com DC pela abordagem da não-biópsia?
Não há evidências para dar suporte à possibilidade de que diagnósticos relevantes sejam perdidos caso a EDA com biópsias sejam omitidas para o diagnóstico da DC. O grupo de trabalho recomenda que a decisão para omitir EDA com biópsias, pode ser tomada não levando em consideração a omissão de outros diagnósticos ou patologias.
Algoritmos
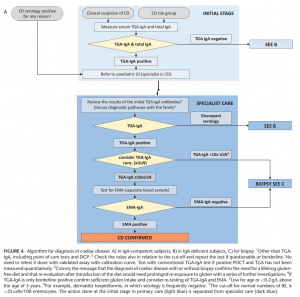
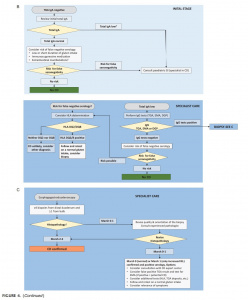
Tomando-se por base as evidências, os algoritmos de 2012 das orientações da ESPGHAN foram modificados para um algoritmo comum (Figura 4), a saber: indivíduos com níveis séricos normais de IgA (Figura 4A), níveis baixos ou ausentes de IgA (Figura 4B) e instruções para biópsias duodenais (Figura 4C) .
Figura 4 continuação.
Conclusões
As atuais orientações diagnósticas levam em consideração novas evidências, a maioria delas advindas de inúmeros estudos, inspiradas pela publicação de normas prévias. Nem todas os postulados das diretrizes de 2012 foram baseados em um grau similar de evidência. A maioria dos estudos informativos conduzidos em anos recentes, têm confirmado a substancial correção das guias de conduta de 2012, porém, ao mesmo tempo indicam que é necessário considerar que o processo está sempre em evolução e, ainda assim, distante de ser concluído.
Meus Comentários
A Doença Celíaca (DC) é uma enfermidade autoimune caracterizada pela intolerância permanente ao glúten da dieta contido no trigo, cevada e centeio. A DC apresenta uma característica extremamente peculiar em relação às outras enfermidades autoimunes, porque para que ela ocorra é necessário que exista a contribuição de um fator ambiental-alimentar, claramente identificável (o glúten), associado à presença, no paciente, de um Antígeno de Histocompatibilidade (HLA – human leukocytes antigen) dominante, DQ2 ou DQ8.
A DC é, portanto, o resultado da interação entre o glúten e fatores imunológicos, genéticos e ambientais. A gliadina, a fração solúvel em álcool do glúten, é uma proteína rica em aminoácidos de glutamina e prolina, e que é pobremente degradada pelas enzimas digestivas. As moléculas não digeridas da gliadina atravessam a barreira de permeabilidade intestinal, provavelmente durante um processo infeccioso ou quando há um aumento da permeabilidade por qualquer outra razão, e interage com as células apresentadoras de antígeno da lâmina própria da mucosa intestinal.
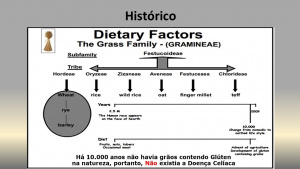
É fato reconhecido pelos historiadores que há cerca de 10.000 anos não havia grãos contendo glúten na natureza, e, portanto, presumivelmente, também não existia a DC. Com o advento da agricultura, o trigo e outros grãos contendo glúten passaram a ser cultivados extensivamente, o que veio a fornecer um dos dois elementos chave, o outro é a predisposição genética, para a ocorrência da DC (Figura 1).
Entretanto, foi somente no século I da era cristã que Areteus da Capodócia relatou de forma científica a primeira descrição da DC. Ele descreveu as fezes características, o caráter crônico da enfermidade, a maior incidência na mulher e a possibilidade de crianças serem afetadas. Nos tempos mais recentes, no entanto, deveu-se a Samuel Gee, em 1888, na Inglaterra, a descrição em seu livro “On the celiac afection”, (a palavra Celíaco tem origem no grego e quer dizer “ventre abaulado”) muitas das características clássicas pelas quais ainda atualmente a DC se apresenta, a saber: ”indigestão crônica encontrada em pessoas de todas as idades, especialmente em crianças entre 1 e 5 anos”. Gee sugeriu ainda que a DC ocorreria por um erro dietético, e que a cura poderia ser alcançada pela introdução de uma dieta adequada. Mas, foi somente 60 anos mais tarde que o pediatra holandês Willem Karel Dicke, em 1950, acompanhando diversas crianças com deficiência pondero-estatural e esteatorreia em Haia e Utrecht, provou o efeito deletério do trigo. Ele demonstrou que a fração proteica do trigo, o glúten, em especial a gliadina, é o fator responsável pela instalação da DC. Porém, neste intervalo de tempo inúmeras teorias para explicar sua causa foram propostas, assim como as mais variadas tentativas terapêuticas, as quais estão disponíveis na literatura médica. Por exemplo, Schultz, em 1904, atribuía a causa da DC a uma alteração da flora putrefativa intestinal, enquanto que Herter e Holt, em 1908, propunham que a etiologia se devia à flora de lactobacilos; Henfner, em 1909, considerou a existência de uma grave insuficiência digestiva após o desmame e preconizava a utilização do leite humano. Haas, em 1924, revolucionou o tratamento dietético propondo algo totalmente inédito para sua época, a dieta de banana, inclusive excluindo os carboidratos dos cereais, a qual baixou de forma espetacular a alta mortalidade da DC, e por isso tornou-se muito recomendada até 1950. Stheeman, em 1932, observou que um dos seus pacientes com DC apresentava um agravo do distúrbio diarreico em seguida à ingestão de alimentos contendo amido; a criança revelava intensa idiossincrasia a alimentos como biscoito, pão e farináceos. Ainda em 1932, Parsons fez uma revisão de 94 casos de DC ocorridos na infância e reconheceu que enquanto as crianças eram amamentadas exclusivamente ao seio materno não apresentavam sintomas sugestivos da enfermidade. Afirmava, também, que a DC podia afetar igualmente adultos e crianças, chamando a atenção para a grande variabilidade dos sintomas e para o papel que os carboidratos desempenhavam para o desencadeamento da enfermidade. Em 1934, Luell e Campos descreveram as alterações radiológicas presentes na DC: “motilidade intestinal diminuída, alterações no padrão da mucosa jejunal com ausência do pregueamento característico e fragmentação da coluna de bário”.
Mas, indiscutivelmente, o grande salto de qualidade na melhor compreensão dos efeitos deletérios sobre o organismo provocados pela DC se deveu ao esclarecimento da sua etiologia pelo Professor Dicke. Ele observou que na Segunda Guerra Mundial (1939-1945), durante o período da ocupação nazista na Holanda, em virtude da grande escassez de alimentos, em especial o pão (durante o racionamento não havia disponibilidade de alimentos contendo glúten, e sim outros alimentos contendo carboidratos complexos, como o amido, que embora em pequena quantidade, ainda estavam disponíveis para o consumo), paradoxalmente as crianças portadoras de DC apresentavam uma melhora clínica. Dicke observou também que, durante as internações, quando os pacientes seguiam uma dieta livre de glúten havia uma diminuição da diarreia com desaparecimento da esteatorreia e retomada da normalidade da curva de crescimento. Por outro lado, Dicke notou que após o término da guerra estas mesmas crianças vieram a apresentar uma deterioração clínica quando os Aliados, através do plano Marshall, passaram a suprir alimentos à população, particularmente o pão. Subsequentemente, Dicke publicou uma série de artigos comprovando claramente a associação do trigo e da cevada como causadores da DC.
Vale ressaltar que a primeira descrição da realização da biópsia do intestino delgado se deve a um médico argentino Dr. Royer, que publicou sua façanha na Prensa Médica Argentina, em 1956. No mesmo ano a médica inglesa Dra. Margot Shiner realizou a primeira biópsia de intestino delgado em um paciente com DC e publicou seu feito na revista inglesa The Lancet. Mas somente no início da década de 1960 passou-se a dispor de um equipamento apropriado para a realização rotineira de biópsias de intestino delgado, o qual foi criado por Crosby e Kugler. Vale ressaltar que Crosby era um hematologista que estava interessado em estudar a absorção intestinal de ferro. Para tal se associou ao engenheiro mecânico Kugler para desenvolver um instrumento que pudesse obter amostras de fragmentos de intestino delgado, cujo instrumento acabou sendo batizado de cápsula de Crosby-Kugler. Esta cápsula, sem dúvida alguma resultou no avanço mais espetacular para propiciar o estudo das lesões morfológicas da mucosa intestinal na DC, tornando-se, desde então, até os dias atuais, o padrão ouro no diagnóstico da DC.
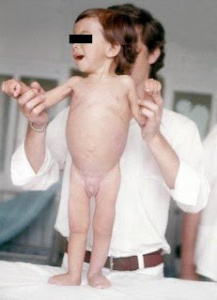
O primeiro caso com comprovação diagnóstica documentada com biópsia de intestino delgado, no Brasil, foi descrito e publicado em 1976, pelo nosso grupo da Gastropediatria da Escola Paulista de Medicina, constituído naquela ocasião por Ulysses Fagundes Neto e Jamal Wehba, após meu retorno da especialização realizada no Policlínico Alejandro Posadas, em Buenos Aires, em 1973, sob a orientação do saudoso Dr. Horácio Toccalino, (Figuras 2-3-4-5-6) (Fagundes Neto, U. Ped. Prát. 47(11-12): 23-26, 1976).
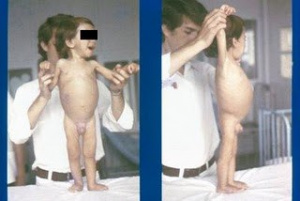
Figura 2 – Nosso primeiro paciente com DC no momento da internação evidenciando desnutrição grave e grande irritabilidade..
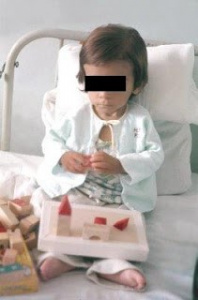
Figura 4- Nosso paciente alguns dias após o diagnóstico e em dieta isenta de glúten. Começava a recuperar a sociabilidade perdida e a se interessar pelas coisas ao seu redor, inclusive os brinquedos.
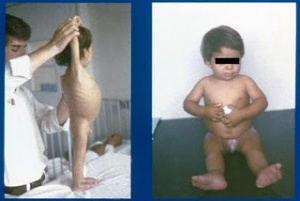
Figura 5 – Comparação nutricional do nosso paciente no momento da internação e após alguns meses em dieta isenta de glúten, com total recuperação clínica e nutricional.
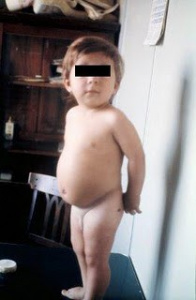
Figura 6 – A importância do diagnóstico correto e cumprir com rigor a dieta isenta de glúten, sem permitir quaisquer transgressões, ainda que esporádicas.
Depois desta primeira descrição muitos outros casos, até então considerados pacientes portadores de desnutrição por verminose ou problemas de ordem sócio-econômica, vieram a ser também diagnosticados. Atualmente sabe-se que a prevalência da DC no nosso meio é tão frequente quanto aquela descrita em outras regiões do mundo de 1:100 indivíduos.
O diagnóstico da DC, como é do conhecimento geral, baseia-se nas alterações morfológicas da mucosa do intestino delgado, as quais embora não sejam patognomônicas, são altamente características, levando a graus variados de atrofia vilositária, infiltrado linfocitário intra-epitelial e hiperplasia das glândulas crípticas (Figura 7).
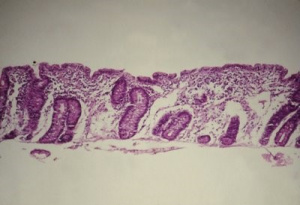
Figura 7 – Microfotografia de biópsia do intestino delgado, em microscopia óptica comum, grande aumento, de paciente portador de Doença Celíaca evidenciando atrofia vilositária total, hiperplasia das glândulas crípticas e aumento dos linfócitos intra-epiteliais.
Vale ressaltar que os sintomas e as lesões morfológicas do intestino delgado são totalmente reversíveis com a introdução de uma dieta isenta de glúten restrita (Figura 8).
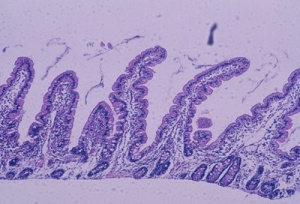
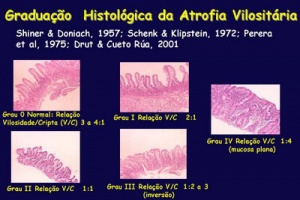
Figura 8- Microfotografia de biópsia do intestino delgado, em microscopia óptica comum, grande aumento, de paciente portador de Doença Celíaca 6 meses após início da dieta isenta de glúten. As vilosidades intestinais encontram-se digitiformes, as glândulas crípitcas normais e o infiltrado linfo-plasmocitário da lâmina própria discreto, células epiteliais cilíndricas com núcleo em posição basal e glândulas crípticas preservando a relação vilosidade/cripta 4ou5:1. Presentemente, os critérios diagnósticos de graduação das alterações morfológicas da mucosa intestinal aceitos internacionalmente para o diagnóstico da DC são os propostos por Marsh, em 1992 (Figuras 9-10).
Marsh classificou as alterações histológicas para o diagnóstico da DC nos seguintes graus, a saber: Grau 0, estágio pré-infiltrativo (normal), Grau 1, lesão infiltrativa (aumento do número de linfócitos intra-epiteliais), Grau 2, lesão hiperplásica (Grau 1 + hiperplasia das criptas), Grau 3, lesão destrutiva (Grau 2 + atrofia vilositária parcial), Grau 4, lesão hipoplásica (atrofia vilositária total com hipoplasia críptica). A lesão Grau 3 foi modificada para ser subdividida em Grau 3a (atrofia vilositária parcial), Grau 3b (atrofia vilositária subtotal) e Grau 3c (atrofia vilositária total).
A existência de lesão Marsh Grau 3 com atrofia vilositária, ou mais intensa, é aceita como claro aspecto diagnóstico da DC. A ocorrência de lesão Marsh Grau 2 associada à positividade de marcadores sorológicos é altamente sugestiva da DC. A existência da lesão histológica Marsh Grau 1 é considerada inespecífica, porém, se essa lesão vier acompanhada de positividade dos marcadores sorológicos deve-se considerar fortemente o diagnóstico de DC. Nesta situação deve-se realizar a tipagem HLA e se necessário repetir a biópsia do intestino delgado, ou então, indicar o emprego da dieta isenta de glúten e após 6 meses repetir os testes sorológicos e a biópsia do intestino delgado.
Muito embora eu nutra um profundo respeito pelo grupo de trabalho da ESPGHAN sinto-me no direito de discordar especificamente quanto ao critério diagnóstico não-biópsia pelas seguintes razões, a saber:
1 – Os testes sorológicos ainda que se revistam de extraordinária importância como rastreamento diagnóstico da DC nem sempre apresentam 100% de sensibilidade e especificidade. Além disso, podem apresentar variabilidade dependendo da metodologia de cada laboratório e dos diferentes locais aonde os testes são realizados.
2. Por outro lado, atualmente a endoscopia digestiva alta passou a ser um exame extremamente seguro, rotineiro na prática médica, desde longa data, e praticamente de domínio universal. Além disso, durante a realização do próprio procedimento é possível se fazer uma avaliação macroscópica inicial ao se visualizar, pela lupa, na estrutura da mucosa duodenal, a ausência das pregas de Kerkring. Isto permite que as biópsias possam ser dirigidas diretamente para estas áreas focais de lesão, posto que as alterações da mucosa não são necessariamente sempre difusas.
3 – Considerando-se que estamos tratando de uma enfermidade que envolve uma intolerância permanente ao trigo, centeio e cevada, alimentos que fazem parte fundamental da nossa cultura alimentar ocidental, parece-me indispensável que tenhamos a absoluta certeza do diagnóstico definitivo de DC. Esta certeza é a base para que possamos transmitir, com total confiança aos pais e aos pacientes, a imperiosa necessidade para que seja cumprida de forma restrita a dieta isenta de glúten.
4 – Como é do conhecimento geral a necessidade da adesão a uma dieta isenta de glúten de forma restrita diz respeito à prevenção de uma série de potenciais efeitos colaterais da DC quando ocorrem transgressões dietéticas. Dentre os inúmeros efeitos colaterais podemos citar osteoporose, deficiências das vitaminas lipossolúveis, parada do ritmo de crescimento, outras enfermidades autoimunes (Diabetes, Tireoidite), neoplasia intestinal etc.
Isto posto, devo reafirmar a importância da realização de oficinas de trabalho, como a atual publicação, que leva em consideração as revisões sistemáticas baseadas em evidências, valorizando acima de tudo a ciência, a despeito da possível existência de algumas menores discordâncias, posto que a Medicina não é uma ciência exata.
Referências Bibliográficas
- Husby S – JPGN 2020; 70:141-157
- Husby S – JPGN 2012; 54:136-60
- Ludvigsson JF – Gut 2014; 63:1210-28
- Rubio-Tapia A – Am J Gastroenterol 2013; 108:656-76
Marcadores
sorológicos ajudam a confirmar a hipótese de doença celíaca | Revista Médica
Ed. 8 - 2003
A presença de aticorpos contra gliadina, endomísio e
transglutaminase é indicativa da doença.
A presença de aticorpos contra gliadina, endomísio
e transglutaminase é indicativa da doença.
A doença celíaca acomete tanto crianças quanto
adultos e freqüentemente seu quadro clínico exige diagnóstico diferencial com
outras afecções do trato gastrointestinal. As manifestações clínicas podem ser
relativamente brandas, com sintomas como vômitos, desconforto abdominal e
diarréia ou obstipação, ou mais intensas, com quadro de síndrome de
mal-absorção. Em adultos, muitas vezes essa hipótese é confirmada a partir da
investigação de anemia ferropriva. O diagnóstico se baseia na correta
interpretação dos achados de biópsia do intestino delgado, em conjunto com os
marcadores sorológicos para a doença celíaca.Executa-se a sorologia para
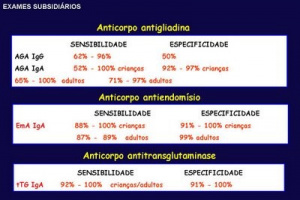
três desses anticorpos: antigliadina, antiendomísio e antitransglutaminase.
Testes sorológicos para o diagnóstico da doença
celíaca
|
Teste |
Ig pesquisada |
Técnica |
Sensibilidade (%) |
Especificidade (%) |
|
Antigliadina |
IgA/IgG |
ELISA |
>IgG – 65-85 |
IgG – 73-90 |
|
Antiendomísio |
IgA |
IFI |
85-98 |
97-100 |
|
Antitransglutaminase |
IgA |
ELISA |
95-98 |
95 |
Novas diretrizes para o diagnóstico da doença celíaca pediátrica –
Sociedade Europeia de Gastroenterologia, Hepatologia e Nutrição Pediátrica
(ESPGHAN)
27 de fevereiro de 2020
- O
documento da ESPGHAN relembra que a doença celíaca é
subdiagnosticada devido à apresentação variada de sinais e sintomas
clínicos, devendo ser suspeitada na presença de sinais e sintomas
gastrointestinais – diarréia crônica ou intermitente,
constipação, dor abdominal, distensao abdominal, náusea
/vômitos recorrentes; sintomas extra-intestinais variados – perda de
peso, deficit pondero-estatural, atraso puberal, irritabilidade,
fadiga, neuropatia, artrite/artralgia, anemia crônica por deficiência
de ferro, mineralização óssea reduzida, aftas
recorrentes, dermatite herpetiforme, defeitos no esmalte
dental, bioquímica hepática anormal; e em condições específicas de risco
aumentado da doença – antecedente familiar primeiro
grau, condições auto-imunes como DM1, sindrome de Down, sindrome
de Turner, deficiência de IgA, dentre outras.
- Segundo
a ESPGHAN, o diagnóstico de doença celíaca pode ser preciso e
estabelecido com segurança com ou sem biópsias duodenais, se seguindo
recomendações apropriadamente.
- Testes
para IgA total e IgA anti-transglutaminase devem ser usados para
crianças com suspeita de doença celíaca. Em crianças com valores séricos
normais de IgA para a idade, a IgA-antitransglutaminase deve ser
usada, independentemente da idade. Em crianças com valor de IgA
total baixo, um teste baseado em IgG precisa ser usado como segundo passo.
- Endoscopia
com biópsias duodenais devem ser realizada em crianças com
IgA-antitransglutaminase positivo, mas títulos mais baixos (<10 vezes
limite do normal). Os pacientes devem ter ?4 biópsias do duodeno distal e
?1 do bulbo, durante uma dieta contendo glúten.
- A
avaliação das biópsias deve ser realizada em biópsias em orientação
apropriada. Em casos de resultados discrepantes entre
IgA-antitransglutaminase e
histopatologia, reavaliação da biópsia e/ou segunda
opinião de um patologista experiente devem ser solicitados.
- Uma
abordagem sem biópsia é apropriada para crianças com valores de
IgA-antitransglutaminase ?10 vezes o limite superior e anticorpos
anti-endomisio (IgA) positivo em segunda amostra.
- Testes
de HLA e presença de sintomas não são obrigatórios para um
diagnóstico sem biópsia.
- Para
diagnóstico de doença celíaca sem biópsia, a concentração sérica de
IgA-antitransglutaminase> 10xo limite superior da normalidade deve ser
obrigatória.
- Pacientes
com deficiência de IgA e que são positivo para um teste sorológico baseado
em IgG deve ser biopsiados.
- “Doença
Celíaca em potencial”: pacientes com IgA-antitransglutaminase
e anti-endomisio positivo e sem alterações histológicas . No
entanto, esses resultados podem ser devido à baixa ingestão de glúten
antes das biópsias, erro de amostragem. Requer vigilância clínica e
laboratorial (sorologia, biópsias adicionais) para monitorar a possível
evolução atrofia das vilosidades e encaminhamento
para especialista com experiência em doença celíaca para
acompanhamento.
Fonte: https://novapediatria.com.br/celiaca-espghan/


Comentários
Postar um comentário