Doença celíaca: características clínicas e métodos diagnósticos
Celiac disease: clinical characteristics and the diagnostic methods
Silvio da Rocha Carvalho1; Josiane Santos de Lima Pereira2; Antonio Celso Cal_ado3; Josther Gracia4; JosU CUsar da Fonseca Junqueira5; Sheila Nogueira PUrcope Rodrigues Guerra6; Marcia Angelica Bonilha Valladares7; M¶nica Maria Cardoso Monnerat8
1. Mestrado (coordenador da residência médica em pediátrica do IPPMG)
2. Especialista em pediatria (médica)
3. Doutor em medicina (professor associado da UFRJ)
4. Doutor em medicina (professor associado)
5. Doutor em medicina (professor adjunto da UFRJ)
6. Mestre em pediatria (professora adjunta da UFRJ)
7. Mestre em medicina (médica da UFRJ)
8. Especilista em endoscopia (médica da UFRJ)
Endereço para correspondência:
Instituto de Puericultura e Pediatria Martagao Gesteira - UFRJ
Rua Bruno Lobo, 50. Cidade Universitária, Campus do Fundao -
Cep: 21.941-912
Resumo
OBJETIVO: Apresentar de forma atualizada o conceito, as características clínicas e os métodos diagnósticos da doença celíaca. Método: Referências obtidas no Medline, arquivos pessoais, artigos recentes de revisão.
RESULTADO: A doença celíaca é uma enteropatia crônica e permanente desencadeada pelo glúten, caracterizada histologicamente por atrofia subtotal ou total da mucosa do intestino delgado causando a síndrome de má-absorção. No indivíduo geneticamente predisposto, o glúten ingerido desencadeia uma reação imunológica, mediada por linfócitos, responsável pela agressão à mucosa intestinal. Pode-se apresentar de forma clássica, atípica ou assintomática. Seu diagnóstico baseia-se na apresentação clínica, nos testes sorológicos específicos e na biópsia de intestino delgado. O tratamento consiste na retirada, de forma permanente, do glúten da dieta.
CONCLUSÃO: A doença celíaca até há pouco tempo era considerada uma doença rara. Resulta da interação de fatores ambientais (glúten), predisposição genética (HLA DQ2/DQ8) e fatores imunológicos (auto-anticorpos). Com o surgimento dos testes sorológicos específicos e a associação da doença com determinados grupos de risco, sua prevalência no Brasil se tornou similar à encontrada na Europa e nos Estados Unidos. Pode afetar diversos órgão e sistemas, o que dificulta seu diagnóstico e tratamento. Os indivíduos não diagnosticados, ou que não seguem as recomendações dietéticas, apresentam um risco elevado de complicações graves e doenças malignas do aparelho digestivo.
Palavras-chave: doença celíaca, síndrome disabsortiva, glúten
Abstract
OBJECTIVE: to Present in an updated of the concept, the clinical characteristics and the diagnostic methods of the celiac disease. Method: References were obtained from Medline, recent review articles and personal files.
RESULT: The celiac disease is a chronic and permanent enteropathy unchained by the gluten, histology has as characteristics subtotal or total atrophy of the mucous membrane of the small intestine causing the disabsortive syndrome. In the individual genetically predisposed, the ingested gluten unchains an immunological reaction mediated by lymphocytes responsible by the aggression to the intestinal mucous membrane. This disease can come in way classic, atypical or asymptomatic. The diagnosis bases on the clinical presentation, specific serological tests and small intestine biopsy. The treatment consists of the retreat, in a permanent way, of the gluten of the diet.
CONCLUSION: The celiac disease even little time a rare disease was considered. It needs the interaction of environmental factors (gluten), genetic predisposition (HLA DQ2/DQ8) and immunological factors (autoimmunity).With the appearance of the specific serological tests and the association of the disease with certain risk groups, its prevalence in Brazil became similar found her in Europe and United States. It can affect several organ and systems, what hinders the diagnosis and treatment. The individuals no diagnosed, or that you don't follow the dietary recommendations, they present a high risk of serious complications and evil diseases of the digestive system.
Keywords: celiac disease, disabsortive syndrome, gluten
Samuel Gee descreveu uma forma de má absorção intestinal, de início gradual na infância, denominada afecção celíaca1. Em 1950, Willem Karel Dicke, na Holanda, estabeleceu a relação do trigo e do centeio com a patogênese da doença, identificando nestes cereais a proteína (glúten) como o principal fator agressor da mucosa intestinal1. No mesmo período, com o surgimento da cápsula para biópsia intestinal per-oral, foi possível a coleta de fragmentos do intestino delgado dos indivíduos suspeitos, evidenciando o processo inflamatório da mucosa intestinal, a atrofia das vilosidades e a hipertrofia das criptas - aspecto histológico até hoje utilizado para o diagnóstico da doença2.
Outro importante marco para o diagnóstico da doença foi a descoberta, em 1970, dos auto-anticorpos glútenes-dependentes3,4. A ocorrência da doença entre familiares foi o primeiro indício da suscetibilidade genética, evidenciada posteriormente pelo antígeno leucoci tário humano (HLA)-DQ25.
Atualmente, a doença celíaca é definida como uma enteropatia crônica mediada por auto-anticorpos, desencadeada pelo glúten, em indivíduos geneticamente predispostos, com manifestações extra-intestinais e intestinais. Caracteriza-se e por atrofia vilositária e hipertrofia das criptas do intestino delgado. As alterações histológicas são reversíveis com a retirada permanente do glúten da dieta1,6,7.
Epidemiologia
A doença celíaca ocorre em todo o mundo, sendo rara em descendentes asiáticos e negros africanos1. Estudos epidemiológicos realizados nos Estados Unidos e na Europa mostram a ocorrência de 0,5%-1% na população geral. Nessas áreas geográficas, a prevalência da doença entre as crianças de 2 anos e 6 meses a 15 anos de idade é de aproximadamente 3-13:10006.
No Brasil, em estudo populacional realizado em doadores de sangue em 1999, através do anticorpo anti-gliadina e anti-endomísio, Gandolfi e al. evidenciaram prevalência de 1:6148. Em 2000, um novo estudo realizado em crianças e adolescentes atendidos em um hospital de Brasília, utilizando o anticorpo anti-endomísio, foi encontrada prevalência de 1:2819. Em 2005, Oliveira realizou triagem em 3000 doadores de sangue em São Paulo, utilizando o anticorpo anti-transglutaminase tecidual, encontrando a prevalência de 1:21410. A real prevalência da doença celíaca varia de acordo com a área geográfica e a seleção dos grupos de indivíduos a serem estudados.
Algumas doenças se destacam por se associarem à doença celíaca, o que ocorre devido a determinantes genéticos ou alterações imunológicas comuns11.
Quando se investigam parentes de 1º grau de pacientes celíacos, encontra-se uma taxa de 2% a 5% de indivíduos sintomáticos, e até 10% de indivíduos assintomáticos apresentando lesões intestinais compatíveis com a doença12. Fasano e col., em um estudo americano, demonstraram uma prevalência de 4% a 5% nos parentes de 1º grau de pacientes celíacos13. No Brasil, Sdepanian e col., em um estudo semelhante realizado em São Paulo, encontraram uma prevalência de 6,2%, semelhante aos dados da literatura mundial14. Logo, familiares de pacientes celíacos devem ser investigados por meio de sorologia e, se necessário, biópsia do intestino delgado14,15.
Cerca de 8% dos pacientes com diabetes tipo 1 (DM1) apresentam alterações histológicas compatíveis com doença celíaca1,6. Num estudo realizado por Araújo e col., através do anticorpo IgA anti-transglutaminase tecidual, foram triadas 354 crianças e adolescentes diabéticos atendidos no ambulatório de endocrinologia pediátrica em Recife. Foi encontrada uma prevalência de 10,5%, comparável à observada na América do Norte e na Europa, justificando-se a triagem desses pacientes16. A doença celíaca e DM1 são condições auto-imunes resultantes de uma interação complexa entre fatores genéticos, imunológicos e ambientais. Não está claro se a ocorrência simultânea está ligada a uma base genética comum ou se uma doença predispõe a outra. Atualmente, a primeira hipótese é a mais aceita, sendo explicada pelo fato de compartilharem um mecanismo genético comum no sistema HLA (human leukocyte antigen)17.
Indivíduos com doenças auto-imunes como tireoidite auto-imune, alopecia areata, doença de Addison, anemia hemolítica auto-imune, cardiomiopatia auto-imune, síndrome de Sjögren, sarcoidose e artrite crônica juvenil devem ser rastreados com testes sorológicos específicos para doença celíaca15,18.
A síndrome de Down é a anomalia cromossômica mais freqüente, afetando 1:800 recém-nascidos em todo o mundo19. Estudos têm demonstrado que esses pacientes apresentam várias disfunções imunológicas que os predispõem às infecções recorrentes e doenças auto-imunes20,21. Em 1975, Bentley relatou pela primeira vez a associação entre a doença celíaca e esta síndrome22 Nos anos seguintes, vários trabalhos relacionaram-nas em diferentes populações, com prevalência variando entre 3,2%-10,3%23-27. Um estudo realizado com 71 crianças e adolescentes com síndrome de Down no Hospital de Clínicas da Universidade Federal do Paraná (UFPR), utilizando os anticorpos IgA anti-endomísio e IgA anti-transglutaminase, evidenciou uma prevalência de 5,6%, demonstrando a importância da investigação sorológica nestes pacientes28. Certas características da síndrome de Down, como a distensão abdominal e o atraso no crescimento, podem dificultar a lembrança da doença celíaca nesses pacientes. Vários autores consideram que a doença celíaca é subestimada como causa de diarréia, desnutrição ou déficit de desenvolvimento nestes pacientes25,29.
Pode-se observar, também, associação entre doença celíaca e síndrome de Turner30 ou síndrome de Williams31. Outra associação importante é com a deficiência seletiva de IgA. Sabe-se que estes indivíduos possuem um risco elevado em relação à população geral a apresentar doença celíaca15. Estudos realizados na Itália e Irlanda com crianças e adultos mostraram uma prevalência de 2% de deficiência seletiva da IgA entre celíacos32-34. Outros autores citam uma prevalência de até 10%7,15,35. Cabe ressaltar que os testes sorológicos dependentes de IgA podem ser negativos nestes indivíduos15,32.
Patogênese
A doença celíaca necessita da interação de fatores ambientais, genéticos e imunológicos para se manifestar. O principal fator ambiental é o glúten6,7,15,18.
Glúten é um grupo de proteínas presentes dentro do grão de determinados cereais (trigo, centeio, cevada e aveia) que possuem semelhanças nas características taxonômicas e nas seqüências de seus aminoácidos15,18. É dividido em duas frações: gluteninas e prolaminas, sendo esta a fração tóxica para os pacientes celíacos7,15. Cada prolamina tem um nome específico: a gliadina é a do trigo, a secalina, a hordeína e a avenina são as do centeio, cevada e aveia, respectivamente15,18. Gliadina é um monômero e a sua seqüência de aminoácidos é classificada de acordo com o N-terminal em frações α, γ, ω. As gluteninas dividem-se em alto e baixo peso molecular. Esses peptídeos são responsáveis pela ativação das células T CD4+ e do sistema imune inato. As estruturas da prolamina e da glutenina do trigo se assemelham à dos outros cereais7,18.
Em relação à aveia, questiona-se a sua capacidade induzir as alterações histológicas da doença celíaca37. Entretanto, concorda-se com a retirada de produtos à base de aveia da dieta do celíaco pelo risco de contaminação (na colheita, beneficiamento e armazenamento)7,15,36.
Outros fatores ambientais importantes no desencadeamento da doença celíaca nos pacientes susceptíveis são: idade do desmame, época de introdução e quantidade do glúten oferecido na dieta15,37,38, enteroinfecções (bacterianas e virais) e parasitoses intestinais15,17.
Habitualmente são encontrados novos casos nas famílias de paciente celíacos39,40. Num estudo realizado por Greco e col., houve concordância para doença celíaca em 86% dos gêmeos monozigóticos e 20% entre gêmeos dizigóticos41. A concordância do HLA entre irmãos varia de 30% a 40%, mostrando que outros genes não identificados podem estar envolvidos na patogênese da doença celíaca18.
A suscetibilidade à doença celíaca é determinada, em parte, pela associação HLA -especificamente o complexo maior de histocompatibilidade (MHC) classe II HLA-DQA1*0501-DQB1*02(DQ2) e HLA-DQA1*0301-DQB1*0302(DQ8). Esses genes se localizam no braço curto do cromossomo 6 (6p 21.3)6,7,18. Eles codificam glicoproteínas que se ligam a peptídeos formando um complexo antígeno-HLA. Este complexo passa a ser reconhecido por receptores localizados na superfície das células T CD4+ da mucosa intestinal6.
Aproximadamente 90% dos pacientes celíacos possuem o alelo DQ2 positivo e 10%, o alelo DQ8 positivo7,42,43. Por outro lado, 15%-20% da população geral são DQ2 ou DQ8 positivo, evidenciando que esses indivíduos carregam os alelos de risco para a doença celíaca. Se o teste for negativo para ambos DQ2 e DQ8, exclui-se o risco de doença celíaca7. O desenvolvimento da doença celíaca é multigênica, sendo os alelos DQ2 e DQ8 componentes essenciais. Entretanto, outros locus genéticos já foram identificados, incluindo genes nos cromossomos 5q31-3344, 15q11-1345 e 19p13.146.
Em 1983, demonstrou-se a existência de anticorpos da classe IgA contra o endomísio (estrutura do tecido conjuntivo presente em todo o organismo) em soros de pacientes celíacos47 ; porém não era conhecido o alvo destes anticorpos. Em 1997, Dieterich identificou no endomísio esse alvo: a transglutaminase tecidual (TGt)48, enzima intracelular, liberada pelas células do intestino delgado durante situações de stress, inflamação, infecção e apoptose15. Está presente em todas as camadas do intestino delgado e promove a ligação de proteínas extracelulares com o objetivo de estabilizar o tecido conjuntivo49.
Na borda em escova dos enterócitos, a gliadina sofre ação de enzimas proteolíticas, liberando peptídeos chamados imunoestimulatórios (33-mer)18. Esta seqüência de aminoácidos resistentes a proteólise penetra na mucosa (via intracelular ou paracelular), atingindo a lâmina própria. Neste local, sofre deaminação pela TGt, passando a ter uma alta afinidade por receptores (antígenos HLA-DQ2/8) localizados na superfície das células apresentadoras de antígenos (APC)7,18. As APCs vão promover a ativação das células T CD4+, presentes na lâmina própria, provocando a liberação de várias citocinas. Estas citocinas estimulam a maturação de células B e a expansão de plasmócitos que induzem a produção de anticorpos contra a gliadina, o endomísio e a TGt15,18. Neste processo, ocorre a liberação de outras substâncias como o IFN-γ e moléculas pró-inflamatórias que contribuem para o desenvolvimento da doença celíaca18.
Além dos peptídeos imunoestimulatórios (33-mer), a gliadina também possui uma seqüência de peptídeos tóxicos que são fagocitados por macrófagos da lâmina própria intestinal18. Estes macrófagos produzem a IL-15 e o IFN-α que novamente estimulam as APCs a ativarem as células T CD4+, dando continuidade ao processo imunológico7,15,18. As citocinas liberadas neste processo induzem a proliferação de fibroblastos intestinais que produzem fatores degradantes da matriz, levando à atrofia das vilosidades, à hiperplasia das criptas e à infiltração de linfócitos intra-epiteliais (LIE)50.
A TGt é necessária para a ativação do TGF-β, cujo papel é importante na diferenciação do epitélio intestinal e na cicatrização de lesões da mucosa. Desta forma, a presença de anticorpos contra a TGt inativa esta enzima, bloqueando a diferenciação celular, perpetuando, assim, a lesão tecidual51.
Quadro clínico
Forma Clássica ou Gastrointestinal
Manifesta-se na infância, com início entre os 6 meses e os 2 anos de idade, após a introdução do glúten na dieta. Os principais sinais e sintomas são: diarréia crônica ou esteatorréia, distensão abdominal, vômitos, irritabilidade, anorexia, perda de peso ou baixo ganho ponderal com diminuição do tecido celular subcutâneo, e hipotrofia da musculatura, principalmente a glútea6,7,14,15,18.
Outras manifestações decorrentes da síndrome de má-absorção podem ocorrer: equimoses, epistaxe, osteomalácia (déficit de vitaminas lipossolúveis), edema periférico (pela hipoalbuminemia), hipocalemia, hipocalcemia, desidratação e desnutrição grave.
Em crianças com mais de dois anos e nos adultos, podemos encontrar diarréia intermitente, ou constipação intestinal, náuseas, vômitos, desconforto e/ou dor abdominal e perda de peso. Manifestações extra-intestinais dificultam o diagnóstico da doença celíaca7.
Forma Não-Clássica ou Atípica Ocorre mais tardiamente, após os dois anos de vida. Pode ser mono ou oligossintomática14. Há predominância de sinais e sintomas extra-intestinais, explicados pelo déficit nutricional ou por reações imunológicas que acometem diversos órgãos15. Os sinais e sintomas citados abaixo se encontram em ordem decrescente de evidências6.
• Dermatite Herpertiforme: doença bolhosa da pele com depósito de IgA. É uma forma de sensibilidade ao glúten15. Mais de 90% dos pacientes com dermatite herpetiforme, apresentam alterações da mucosa intestinal compatíveis com doença celíaca6,52.
• Hipoplasia do esmalte dentário: defeitos considerados específicos desta doença, se ocorrerem simetricamente e distribuídos cronologicamente em todas as seções dos dentes permanentes15. Na cavidade oral também podemos encontrar aftas de repetição15.
• Osteomalácia, osteoporose e raquitismo: podem ser explicados pela má-absorção de cálcio e vitamina D15,36.
• Baixa estatura: cerca de 10% dos pacientes com baixa estatura idiopática apresenta sorologia positiva54 e atrofia das vilosidades intestinais53.
• Irregularidade menstrual, menarca tardia ou menopausa precoce16,18. Infertilidade e abortos de repetição podem ser explicados pela má-absorção de ácido fólico1,15.
• Anemia ferropriva refratária à reposição de ferro oral e a anemia megaloblástica: resultantes da má-absorção de ferro, vitamina B12 e ácido fólico15. A anemia é a situação clínica mais freqüente nos adultos (5-8,5%) nesta forma da doença54.
• Hipertransaminemia isolada: possível apresentação da doença6,18. Cerca de 4% dos pacientes com hepatite crônica criptogênica são celíacos, normalizando-se as transaminases após dieta de exclusão do glúten18,55-57.
• Artrite e artralgia: cerca de 3% das crianças com artrite reumatóide juvenil são celíacas58.
• Epilepsia com calcificações intracranianas em região occipital: pode ser a única manifestação clínica da doença15,18. Seria explicado pela má-absorção de ácido fólico ou por mecanismos imunológicos no endotélio do SNC59. Ataxia, neuropatia periférica, miopatia e demência também podem ser encontradas nos pacientes celíacos1,15,18.
• Distúrbios psiquiátricos: alterações de humor e depressão. Alteração no metabolismo do triptofano, decorrente da deficiência de piridoxina, pode justificá-los15,36.
Forma Assintomática
O reconhecimento desta forma, principalmente entre os familiares de primeiro grau dos pacientes celíacos e nos grupos de riscos1,15,60, tornou-se mais fácil com a realização dos testes sorológicos específicos61,62. Os testes sorológicos específicos são positivos e existem alterações típicas da mucosa intestinal, mas não ocorrem sintomas. Com a retirada do glúten da dieta, estes pacientes apresentam melhora do humor, da disposição física e do apetite15. Desta forma, conclui-se que estes indivíduos não são verdadeiramente assintomáticos1.
Forma Potencial ou Incipiente
Corresponde a indivíduos que apresentam testes sorológicos específicos positivos sem alterações histológicas da mucosa intestinal. No futuro, estes mesmo indivíduos podem ou não apresentar a doença15,63.Forma Latente
Indivíduos com diagnóstico prévio de doença celíaca (lesão histológica comprovada), quando consumem glúten posteriormente, mantêm-se assintomáticos e sem alterações da mucosa15,63. Acredita-se que alguns pacientes passam a tolerar o glúten ou que a doença demore alguns anos para nova manifestação1.
Diagnóstico
Diagnóstico Clínico
Através da anamnese e do exame clínico criterioso é possível identificar os pacientes que necessitarão de investigação laboratorial15.
Exames Inespecíficos
Em geral refletem o processo de má-absorção intestinal. Apresentam baixa sensibilidade e especificidade.
•Hemograma: anemia microcítica hipocrômica ou anemia megaloblástica;
•Coagulograma: alargamento do tempo de protombina;
•Bioquímica: hipocalcemia, hipofosfatemia, aumento da fosfatase alcalina, hipoalbuminemia e elevação das transaminases;
•Curva de absorção da D-xilose, teste de tolerância à lactose e dosagem da gordura fecal: avaliação indireta da capacidade absortiva da mucosa intestinal. Em desuso atualmente15.
Exames específicos
Testes Sorológicos
Permitem rastrear de forma efetiva um maior número de pessoas15, bem como diagnosticar as formas clínicas leves com sintomas não-característicos.
Recomenda-se dosar a IgA sérica, já que indivíduos com deficiência seletiva de IgA podem apresentar resultado falso-negativo nos testes sorológicos. Nestes pacientes, podemos nos orientar pelos anticorpos da classe IgG1,15.
Anticorpo Anti-gliadina
Foi o primeiro teste a ser comercializado, em 1981. Avalia a presença de anticorpos das classes IgA e IgG contra a gliadina, pelo método ELISA64. Na doença celíaca, a classe IgA é mais específica e a IgG, mais sensível no diagnóstico da doença15,18.
Tem baixo custo, é um exame simples de ser realizado e permite a avaliação de um grande número de soros de uma única vez65. É um bom teste para investigação de crianças abaixo de dois anos de idade e para o controle da adesão à dieta15. Os níveis de anticorpos tornam-se indetectáveis 3 a 6 meses após a dieta sem glúten66.
Apresenta sensibilidade e especificidade inferiores aos outros testes sorológicos específicos67, podendo ocorrer falso-positivo em indivíduos com outras doenças gastrointestinais (como esofagite, gastroenterite, doença inflamatória intestinal, fibrose cística e alergia à proteína do leite de vaca)6.
Anticorpo Anti-endomísio
Foi descoberto em 198315. Utiliza-se o cordão umbilical humano como substrato6,15. Avalia a presença de anticorpos das classes IgA e IgG pela imunofluorescência indireta.
Tem alta sensibilidade e especificidade, custo elevado, interpretação operador-dependente, reação cruzada com enteroparasitos (Giardia lamblia)6,15; falso-positivo na alergia à proteína do leite de vaca47, falso-negativo nos menores de dois anos e nos pacientes com deficiência seletiva de IgA68.
Anticorpo Anti-transglutaminase
Este teste avalia a presença de anticorpos das classes IgA e IgG contra a transglutaminase tecidual. Utiliza-se a técnica de ELISA15.
Tem alta sensibilidade e especificidade6, baixo custo, análise de um grande número de amostras, não sendo operador-dependente15. Pode ocorrer falso-negativo em crianças abaixo de dois anos de idade6,69 e em indivíduos com deficiência seletiva de IgA. Possui menos especificidade que o anti-endomísio.
A eficácia dos testes sorológicos aumenta quando os mesmos são realizados em conjunto6,15,18. A positividade de dois ou mais dos testes sorológicos resulta numa chance próxima de 100% de o indivíduo apresentar doença celíaca70.
A Tabela 1 relaciona a sensibilidade e a especificidade dos testes sorológicos.
Teste HLA DQ2 e DQ8
A doença celíaca está associada com alguns alelos HLA específicos como HLA DQ2 (90% dos casos) e HLA DQ8 (10% dos casos)7.
Este teste tem alta sensibilidade e baixa especificidade, indicando um baixo valor preditivo positivo e um alto valor preditivo negativo, ou seja, indivíduos que apresentam DQ2 ou DQ8 positivos podem ou não apresentar a doença celíaca. Se o teste for negativo para ambos os alelos, exclui-se o diagnóstico de doença celíaca5,6,18,71. É um exame de alto custo.
Biópsia intestinal
O critério de diagnóstico da doença celíaca baseado na biópsia do intestino delgado foi publicado pela ESPGAN em 19701,6,49, sendo necessária a realização de 3 biópsias que comprovassem a relação da mucosa intestinal com o consumo do glúten: uma primeira, no momento do diagnóstico, demonstrando as alterações compatíveis com a doença (atrofia vilositária e hipertrofia das criptas); uma segunda, dois anos após, em vigência de dieta isenta de glúten, demonstrando a recuperação da mucosa intestinal; reintrodução do glúten (desafio com o glúten) e sua manutenção até o aparecimento dos primeiros sinais e sintomas da doença ou um período variável de 3 a 6 meses, quando a terceira biópsia seria realizada1,6,15,72.Em 1990, após a análise de mais de 3 mil pacientes com múltiplas biópsias, a ESPGAN publicou novo critério: crianças com mais de 2 anos de vida com sintomas sugestivos de doença celíaca, testes sorológicos específicos positivos, achados histológicos compatíveis (atrofia vilositária e hipertrofia de criptas) e a resolução clínica após a instituição da dieta sem glúten têm diagnóstico considerado definitivo, sem a necessidade de realização de outras biópsias. Soma-se a isto a negativação dos testes sorológicos específicos1,6,15,18 Em algumas situações, a realização de biópsias adicionais e o desafio com o glúten serão necessários: nas crianças com menos de dois anos, pela maior incidência de alergia à proteína do leite de vaca; pacientes com diagnóstico inicial duvidoso sem biópsia prévia; pacientes com a forma assintomática da doença nos quais não é possível avaliar a resposta clínica; pacientes que questionam o seu diagnóstico e não aderem à dieta sem o glúten15.
O desafio com o glúten poderá ser realizado após um período mínimo de dois anos de dieta7,15. O paciente deverá adicionar produtos com glúten em sua dieta habitual1,15. A biópsia será repetida assim que surgirem os primeiros sinais e sintomas ou de 6 a12 meses após a reintrodução do glúten na dieta. Se normal, os acompanhamentos clínico, laboratorial e sorológico serão mantidos, pois a recidiva poderá ocorrer após vários anos. Este procedimento está contra-indicado nas crianças abaixo de seis anos, para não prejudicar as fases de crescimento rápido e pelo risco de surgirem defeitos no esmalte dentário1,15.
Atualmente, a biópsia do intestino delgado continua sendo considerada o padrão-ouro para o diagnóstico da doença celíaca15,18, podendo ser feita por cápsula via oral ou pela endoscopia digestiva. As características da mucosa observadas durante a endoscopia digestiva alta incluem o achatamento da mucosa, o endenteamento das pregas, vasos sangüíneos da submucosa visíveis e o padrão mosaico da mucosa entre as pregas. Na atrofia parcial pode-se observar achatamento leve ou uma mucosa aparentemente normal. As vantagens da biópsia via endoscópica são a visualização de toda a mucosa e a realização de múltiplas biópsias. Geralmente são feitas duas biópsias na 1ª, 2ª, 3ª e 4ª porções do duodeno6.
As anormalidades histológicas encontradas são: atrofia das vilosidades, alongamento das criptas, aumento dos linfócitos intraepiteliais (> 30/100 enterócitos)6, infiltrado de células plasmáticas na lâmina própria, perda da polaridade do núcleo, ausência da borda em escova e alterações morfológicas das células epiteliais que se tornam cubóides e achatadas66. Marsh, em 1992, propôs uma classificação, atualmente utilizada, demonstrando a seqüência da progressão da mucosa até chegar à atrofia total das vilosidades6,15,73.
Tratamento
Excluem-se da dieta o trigo, o centeio, a cevada, o malte e aveia e seus derivados, permanentemente. A suplementação vitamínica e de oligoelementos (principalmente zinco e ferro)12,15 e a retirada da lactose da dieta em alguns pacientes podem ser necessárias até a recuperação da mucosa intestinal que se fará em tempo variável (2 a 4 semanas), após a instituição da dieta15,18. Para uma melhor adesão ao tratamento é necessário compreender a doença e suas complicações. Toda a família deve estar engajada na ajuda ao paciente.
Em 1994, pais de pacientes celíacos criaram a ACELBRA (Associação dos Celíacos do Brasil - Seção São Paulo). Esta associação tem como objetivos orientar os pacientes quanto à doença e à dieta; divulgar a doença através dos meios de comunicações; incentivar, junto aos órgãos governamentais, a pesquisa e a análise dos produtos industrializados ingeridos, ou utilizados pelos celíacos; e cadastrar os novos pacientes (www.acelbra.org.br/2004/porque.php). Hoje a ACELBRA está presente em vários estados brasileiros.
Em 23 dezembro de 1992 foi promulgada a Lei 8543, determinando a impressão de advertência CONTÉM GLÚTEN nos produtos industrializados à base de trigo, malte, cevada, centeio e aveia (www.acelbra.org.br/2004/objetivos.php). A Lei 10.674, sancionada em 2003, obriga os fabricantes de produtos industrializados a informarem em embalagens, rótulos e bulas a inscrição CONTÉM GLÚTEN ou NÃO CONTÉM GLÚTEM (www.acelbra.org.br/2004/leis.php).
Complicações
Indivíduos não diagnosticados, negligenciados ou que não seguem as recomendações dietéticas, apresentam um grande risco de morbiletalidade a médio e a longo prazo15. Baixa estatura, infertilidade, osteoporose, osteomalácia, raquitismo, distúrbios neurológicos, psiquiátricos, doenças auto-imunes, linfoma, câncer de boca, faringe e esôfago se destacam entre as complicações15,36.
Uma complicação rara e extremamente grave é a crise celíaca. Geralmente acomete crianças abaixo de dois anos. Ocorre diarréia grave, grande perda de peso, desidratação com distúrbios eletrolíticos e ácido-básicos importantes. O tratamento é feito com a reposição de fluidos, eletrólitos e corticosteróides, levando à reversão rápida dos sintomas15,18.
Prognóstico
Os pacientes que aderem à dieta apresentam, após 5 anos, risco igual ao da população em geral para malignidade. A maioria dos agravos advindos da doença celíaca em atividade é reversível, principalmente se diagnosticados precocemente15.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Hill ID, Bhatnagar S, Cameron DJ, De Rosa S, Maki M, Russell GJ, et al. Celiac disease: Working Group Report of the First World Congress of Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr. 2002;35 Suppl 2:S78-88.
2. Hallert C. The epidemiology of celiac disease: a continuos enigma.S. Lohiniemi, P. Collin and M. Mäki; Changing Features of Coeliac Disease; Tampere; 1999:83-7.
3. Seah PP, Fry L, Hoffbrand AV, Holborow EJ. Tissue antibodies in dermatitis herpetiformis and adult coeliac disease. Lancet. 1971;1:834-6
4. Seah PP, Fry L, Rossiter MA, Hoffbrand AV, Holborow EJ. Anti-reticulin antibodies in childhood coeliac disease. Lancet. 1971;2:681-2
5. Sollid LM, Markussen G, Ek J, Gjerde H, Vartdal F, Thorsby E. Evidence for a primary association of celiac disease to a particular HLA-DQ alpha/beta heterodimer. J Exp Med. 1989;169:345-50
6. Hill ID, Dirks MH, Liptak GS, Colletti RB, Fasano A, Guandalini S, et al. Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2005;40:1-19
7. Mäki M, Lohi O. Enteropathy -Celiac Disease.W. A. Walker, O. Goulet and R. E. Kleinmain; Pediatric Gastrointestinal Disease - Pathophysiology Diagnosis Management; 2004: 4th ed. 932-43.
8. Gandolfi L, Pratesi R, Cordoba JC, Tauil PL, Gasparin M, Catassi C. Prevalence of celiac disease among blood donors in Brazil. Am J Gastroenterol. 2000;95:689-92
9. Gandolfi L, Bocca AL, Pratesi R. Screening of celiac disease in children attending the outpatient clinic of a university hospital. J Pediatr Gastroenterol Nutr. 2000;31:S212-S213 (abstrac 830)
10. Oliveira RP, Sdepanian VL, Barreto JA, Cortez AJ, Carvalho FO, Bordin JO, et al. High prevalence of celiac disease in Brazilian blood donor volunteers based on screening by IgA antitissue transglutaminase antibody. Eur J Gastroenterol Hepatol. 2007;19:43-9
11. Collin P, Kaukinen K. Associated disorders in celiac disease.S. Lohiniemi, P. Collin and M. Mäki; In:Changing Features of Coeliac Disease; Tampere; 1999:89-9.
12. Behrman RE, Kliegman RM, Jenson HB. Nelson Tratado de Pediatria.B. e. Kliegman; Rio de Janeiro; 2002: 16ª ed. 1151-52.
13. Fasano A, Berti I, Gerarduzzi T, Not T, Colletti RB, Drago S, et al. Prevalence of celiac disease in at-risk and not-at-risk groups in the United States: a large multicenter study. Arch Intern Med. 2003;163:286-92
14. Sdepanian VL, Moraes MB, Fagundes-Neto U. Celiac disease: clinical characteristics and methods used in the diagnosis of patients registered at the Brazilian Celiac Association. J Pediatr (Rio J). 2001;77:131-8
15. Brant KG, Gap GAP. Gastroenterologia e Hepatologia Pediátrica - diagnóstico e tratamento.E. S. C.T. Ferreira; Doença Ceçíaca; 2003:161-174.
16. Araujo J, da Silva GA, de Melo FM. Serum prevalence of celiac disease in children and adolescents with type 1 diabetes mellitus. J Pediatr (Rio J). 2006;82:210-4
17. Collin P, Kaukinen K, Valimaki M, Salmi J. Endocrinological disorders and celiac disease. Endocr Rev. 2002;23:464-83
18. Troncone R, Auricchio S. In: Pediatric Gastrointestinal and Liver Disease - Pathophysiology Diagnosis Management. editors Wyllie R and Hyans JS: Saunders Elsevier - Celiac Disease; New York; 2006: 3th. 517-527.
19. Pueschel SM. Physical characteristics, chromosome analysis and treatment approaches in Down syndrome.Down syndrome: a resource handbook; College-Hill Press/Little, Brown & Co In: Tingey C. ; Boston; 1988: p.3-21.
20. Avanzini MA, Monafo V, De Amici M, Maccario R, Burgio GR, Plebani A, et al. Humoral immunodeficiencies in Down syndrome: serum IgG subclass and antibody response to hepatitis B vaccine. Am J Med Genet Suppl. 1990;7:231-3
21. Nespoli L, Burgio GR, Ugazio AG, Maccario R. Immunological features of Downs syndrome: a review. J Intellect Disabil Res. 1993;37(Pt 6):543-51
22. Bentley D. A case of Downs syndrome complicated by retinoblastoma and celiac disease. Pediatrics. 1975;56:131-3
23. Bonamico M, Mariani P, Danesi HM, Crisogianni M, Failla P, Gemme G, et al. Prevalence and clinical picture of celiac disease in italian down syndrome patients: a multicenter study. J Pediatr Gastroenterol Nutr. 2001;33:139-43
24. Book L, Hart A, Black J, Feolo M, Zone JJ, Neuhausen SL. Prevalence and clinical characteristics of celiac disease in Downs syndrome in a US study. Am J Med Genet. 2001;98:70-4
25. Csizmadia CG, Mearin ML, Oren A, Kromhout A, Crusius JB, von Blomberg BM, et al. Accuracy and cost-effectiveness of a new strategy to screen for celiac disease in children with Down syndrome. J Pediatr. 2000;137:756-61
26. Kolek A, Vospelova J, Hermanova Z, Santava A, Tichy M. Occurrence of coeliac disease in children with Downs syndrome in north Moravia, Czech Republic. Eur J Pediatr. 2003;162:207-8
27. Rumbo M, Chirdo FG, Ben R, Saldungaray I, Villalobos R. Evaluation of coeliac disease serological markers in Down syndrome patients. Dig Liver Dis. 2002;34:116-21
28. Nisihara RM, Kotze LM, Utiyama SR, Oliveira NP, Fiedler PT, Messias-Reason IT. Celiac disease in children and adolescents with Down syndrome. J Pediatr (Rio J). 2005;81:373-6
29. Hilhorst MI, Brink M, Wauters EA, Houwen RH. Down syndrome and coeliac disease: five new cases with a review of the literature. Eur J Pediatr. 1993;152:884-7
30. Bonamico M, Pasquino AM, Mariani P, Danesi HM, Culasso F, Mazzanti L, et al. Prevalence and clinical picture of celiac disease in Turner syndrome. J Clin Endocrinol Metab. 2002;87:5495-8
31. Giannotti A, Tiberio G, Castro M, Virgilii F, Colistro F, Ferretti F, et al. Coeliac disease in Williams syndrome. J Med Genet. 2001;38:767-8
32. Cataldo F, Marino V, Bottaro G, Greco P, Ventura A. Celiac disease and selective immunoglobulin A deficiency. J Pediatr. 1997;131:306-8
33. Cataldo F, Marino V, Ventura A, Bottaro G, Corazza GR. Prevalence and clinical features of selective immunoglobulin A deficiency in coeliac disease: an Italian multicentre study. Italian Society of Paediatric Gastroenterology and Hepatology (SIGEP) and "Club del Tenue" Working Groups on Coeliac Disease. Gut. 1998;42:362-5
34. Heneghan MA, Stevens FM, Cryan EM, Warner RH, McCarthy CF. Celiac sprue and immunodeficiency states: a 25-year review. J Clin Gastroenterol. 1997;25:421-5
35. Korponay-Szabo IR, Dahlbom I, Laurila K, Koskinen S, Woolley N, Partanen J, et al. Elevation of IgG antibodies against tissue transglutaminase as a diagnostic tool for coeliac disease in selective IgA deficiency. Gut. 2003;52:1567-71
36. Hoffenberg EJ, Haas J, Drescher A, Barnhurst R, Osberg I, Bao F, et al. A trial of oats in children with newly diagnosed celiac disease. J Pediatr. 2000;137:361-6
37. Ivarsson A, Hernell O, Stenlund H, Persson LA. Breast-feeding protects against celiac disease. Am J Clin Nutr. 2002;75:914-21
38. Ivarsson A, Persson LA, Nystrom L, Ascher H, Cavell B, Danielsson L, et al. Epidemic of coeliac disease in Swedish children. Acta Paediatr. 2000;89:165-71
39. Book L, Zone JJ, Neuhausen SL. Prevalence of celiac disease among relatives of sib pairs with celiac disease in U.S. families. Am J Gastroenterol. 2003;98:377-81
40. Mustalahti K, Sulkanen S, Holopainen P, Laurila K, Collin P, Partanen J, et al. Coeliac disease among healthy members of multiple case coeliac disease families. Scand J Gastroenterol. 2002;37:161-5
41. Greco L, Romino R, Coto I, Di Cosmo N, Percopo S, Maglio M, et al. The first large population based twin study of coeliac disease. Gut. 2002;50:624-8
42. Sollid LM, Thorsby E. HLA susceptibility genes in celiac disease: genetic mapping and role in pathogenesis. Gastroenterology. 1993;105:910-22
43. Spurkland A, Ingvarsson G, Falk ES, Knutsen I, Sollid LM, Thorsby E. Dermatitis herpetiformis and celiac disease are both primarily associated with the HLA-DQ (alpha 1*0501, beta 1*02) or the HLA-DQ (alpha 1*03, beta 1*0302) heterodimers. Tissue Antigens. 1997;49:29-34
44. Babron MC, Nilsson S, Adamovic S, Naluai AT, Wahlstrom J, Ascher H, et al. Meta and pooled analysis of European coeliac disease data. Eur J Hum Genet. 2003;11:828-34
45. Woolley N, Holopainen P, Ollikainen V, Mustalahti K, Maki M, Kere J, et al. A new locus for coeliac disease mapped to chromosome 15 in a population isolate. Hum Genet. 2002;111:40-5
46. Van Belzen MJ, Meijer JW, Sandkuijl LA, Bardoel AF, Mulder CJ, Pearson PL, et al. A major non-HLA locus in celiac disease maps to chromosome 19. Gastroenterology. 2003;125:1032-41
47. Chan KN, Phillips AD, Mirakian R, Walker-Smith JA. Endomysial antibody screening in children. J Pediatr Gastroenterol Nutr. 1994;18:316-20
48. Dieterich W, Ehnis T, Bauer M, Donner P, Volta U, Riecken EO, et al. Identification of tissue transglutaminase as the autoantigen of celiac disease. Nat Med. 1997;3:797-801
49. European Society For Paediatric Gastroenterology. Acta Paediatrica. 1970;59:461-464
50. Sblattero D, Berti I, Trevisiol C, Marzari R, Tommasini A, Bradbury A, et al. Human recombinant tissue transglutaminase ELISA: an innovative diagnostic assay for celiac disease. Am J Gastroenterol. 2000;95:1253-7
51. Schuppan D, Dieterich W, Riecken EO. Exposing gliadin as a tasty food for lymphocytes. Nat Med. 1998;4:666-7
52. Russo PA, Chartrand LJ, Seidman E. Comparative analysis of serologic screening tests for the initial diagnosis of celiac disease. Pediatrics. 1999;104:75-8
53. Cacciari E, Salardi S, Volta U, Biasco G, Lazzari R, Corazza GR, et al. Can antigliadin antibody detect symptomless coeliac disease in children with short stature? Lancet. 1985;1:1469-71
54. Corazza GR, Valentini RA, Andreani ML, DAnchino M, Leva MT, Ginaldi L, et al. Subclinical coeliac disease is a frequent cause of iron-deficiency anaemia. Scand J Gastroenterol. 1995;30:153-6
55. Davison S. Coeliac disease and liver dysfunction. Arch Dis Child. 2002;87:293-6
56. Vajro P, Fontanella A, Mayer M, De Vincenzo A, Terracciano LM, DArmiento M, et al. Elevated serum aminotransferase activity as an early manifestation of gluten-sensitive enteropathy. J Pediatr. 1993;122:416-9
57. Volta U, De Franceschi L, Lari F, Molinaro N, Zoli M, Bianchi FB. Coeliac disease hidden by cryptogenic hypertransaminasaemia. Lancet. 1998;352:26-9
58. Lepore L, Martelossi S, Pennesi M, Falcini F, Ermini ML, Ferrari R, et al. Prevalence of celiac disease in patients with juvenile chronic arthritis. J Pediatr. 1996;129:311-3
59. Gobbi G, Bouquet F, Greco L, Lambertini A, Tassinari CA, Ventura A, et al. Coeliac disease, epilepsy, and cerebral calcifications. The Italian Working Group on Coeliac Disease and Epilepsy. Lancet. 1992;340:439-43
60. Corazza G, Valentini RA, Frisoni M, Volta U, Corrao G, Bianchi FB, et al. Gliadin immune reactivity is associated with overt and latent enteropathy in relatives of celiac patients. Gastroenterology. 1992;103:1517-22
61. Misra S, Ament ME. Diagnosis of coeliac sprue in 1994. Gastroenterol Clin North Am. 1995;24:133-43
62. Reeves GE, Squance ML, Duggan AE, Murugasu RR, Wilson RJ, Wong RC, et al. Diagnostic accuracy of coeliac serological tests: a prospective study. Eur J Gastroenterol Hepatol. 2006;18:493-501
63. Stern M. Comparative evaluation of serologic tests for celiac disease: a European initiative toward standardization. J Pediatr Gastroenterol Nutr. 2000;31:513-9
64. Branski D, Troncone R. Celiac disease: a reappraisal. J Pediatr. 1998;133:181-7
65. Calabuig M, Torregosa R, Polo P, Tuset L, Tomas C, Alvarez V, et al. Serological markers and celiac disease: a new diagnostic approach? J Pediatr Gastroenterol Nutr. 1990;10:435-42
66. Fotoulaki M, Nousia-Arvanitakis S, Augoustidou-Savvopoulou P, Kanakoudi-Tsakalides F, Zaramboukas T, Vlachonikolis J. Clinical application of immunological markers as monitoring tests in celiac disease. Dig Dis Sci. 1999;44:2133-8
67. Farrell RJ, Kelly CP. Celiac sprue. N Engl J Med. 2002;346:180-8
68. Ferreira M, Davies SL, Butler M, Scott D, Clark M, Kumar P. Endomysial antibody: is it the best screening test for coeliac disease? Gut. 1992;33:1633-7
69. Burgin-Wolff A, Gaze H, Hadziselimovic F, Huber H, Lentze MJ, Nussle D, et al. Antigliadin and antiendomysium antibody determination for coeliac disease. Arch Dis Child. 1991;66:941-7
70. Pocecco M, Ventura A. Coeliac disease and insulin-dependent diabetes mellitus: a causal association? Acta Paediatr. 1995;84:1432-3
71. Kaukinen K, Partanen J, Maki M, Collin P. HLA-DQ typing in the diagnosis of celiac disease. Am J Gastroenterol. 2002;97:695-9
72. Martelossi S, Zanatta E, Del Santo E, Clarich P, Radovich P, Ventura A. Dental enamel defects and screening for coeliac disease. Acta Paediatr Suppl. 1996;412:47-8
73. Marsh MN. Gluten, major histocompatibility complex, and the small intestine. A molecular and immunobiologic approach to the spectrum of gluten sensitivity (celiac sprue). Gastroenterology. 1992;102:330-54
AVALIAÇÃO
1. A anomalia cromossômica mais comumente associada a adoenças celíaca é:
a) diabetes mellitus
b) síndrome de Turner
c) síndrome de Williams
d) síndrome de Down
2. Dentre as manifestações abaixo, qual o com maior grau de evidência de relação com doeça celíaca?
a) baixa estatura
b) anemia ferropriva
c) hipoplasia do esmante dentário
d) artralgia
3. Em crianças acima de dois anos, qual o pareamento de testes com maior eficácia para triagem da doença celíaca?
a) anti-gliadina IgA e anti gliadina IgG
b) anti-transglutaminase IgA e anti-endomísio IgA
c) anti-endomísio IgA e anti-gliadina IgA
d) anti-glidiana IgA e anti-transglutaminase IgA
Fonte:http://revistadepediatriasoperj.org.br/detalhe_artigo.asp?id=115
Conheça as formas de
diagnóstico da doença celíaca
A doença celíaca é uma doença autoimune e afeta o intestino delgado, causando um processo infamatório crônico e prejudicando a absorção de nutrientes. O agente causador é o glúten, uma proteína presente no trigo, centeio e na cevada.
Estima-se que 1% da população mundial tenha doença celíaca, inclusive levando a óbito cerca de 42 mil crianças por ano. No Brasil, são 2 milhões de pessoas afetadas, porém, este número pode ser maior, pois ainda há muitos casos sem diagnóstico.
Sintomas
Em cada faixa etária, ocorrem manifestações diferentes:

Crianças
– Diarreia
– Distensão abdominal
– Problemas de desenvolvimento
– Vômitos
– Irritabilidade
– Falta de apetite
– Em alguns casos, prisão de ventre

Adolescência
– Anemia
– Baixa estatura
– Sintomas neurológicos

Adultos
– Crises de diarreia (em apenas metade dos casos)
– Desconforto abdominal
– Anemia por deficiência de ferro
– Osteoporose
– Emagrecimento
– Dermatites
– Redução nos níveis de cálcio
– Alterações hepáticas
– Prisão de ventre
Boa parte dos celíacos são do sexo feminino. Para cada caso de um homem com a doença celíaca, existem outros 2 ou 3 em mulheres.
Como é feito o diagnóstico da doença celíaca?
Muitos pacientes podem demorar a receber um diagnóstico preciso da doença celíaca, pois como há uma grande variedade de sintomas apenas a observação clínica não é suficiente.
Por isso, é necessário combinar a análise clínica, laboratorial e histopatológica para ter um resultado preciso.
Análise Clínica
O profissional da saúde verifica a recorrência dos sintomas reclamados pelo paciente.
Análise Laboratorial
Seguindo o protocolo clínico do SUS, o médico poderá solicitar um exame de sangue para verificar a dosagem de imunoglobina IgA e anticorpo antitrasglutaminase IgA e IgG.
Se der positivo, o paciente é encaminhado para a biópsia.
Análise histopatológica
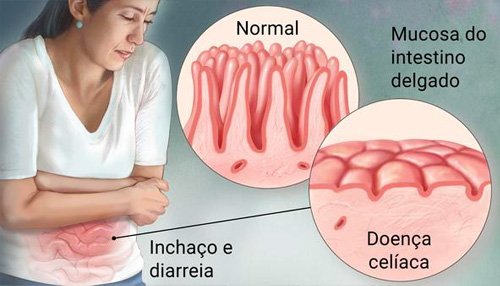
É realizada uma endoscopia com biópsia do bulbo e intestino delgado. No paciente celíaco a mucosa do intestino apresenta vilosidade achatada (atrofiadas).
Este é o exame considerado padrão-ouro para o diagnóstico da doença celíaca. Caso a análise da amostra seja inconclusiva ou não seja recomendado o paciente realizar este método invasivo, é possível recorrer ao estudo genético.
Análise genética
O teste é bastante útil para descartar a doença celíaca. Estudos recentes demonstram que a presença dos marcadores DQ2 e DQ8 compondo o antígeno HLA estão associados a doença celíaca. Contudo, 15% a 30% da população geral também apresentam estes marcadores, apesar de não terem a doença.
O exame então serve para excluir a possibilidade de doença celíaca, pois se o paciente não apresentar os marcadores DQ2 e DQ8 há 99% de chance de ter um diagnóstico negativo.
O que é o HLA?
O sistema leucocitário humano, o HLA, é responsável por ajudar o sistema imunológico a codificar proteínas e reagir a organismos que considere “estranhos” ao corpo. Quando reconhece um antígeno estranho, desencadeia uma resposta com o objetivo de destruí-lo.
Este corpo estranho pode ser um vírus ou bactéria, mas também pode ser um tecido, órgão ou medula transplantado.
Para realizar transplantes é feito justamente o estudo de compatibilidade entre o HLA do doador e do receptor, para que o órgão não corra o risco de ser rejeitado.
O complexo HLA tem muitas variações (mais de 11 mil já foram identificadas) que permite o sistema imunológico de cada pessoa reaja a uma ampla gama de proteínas externas.
A presença de certas variantes do gene HLA aumentam o risco de desenvolver doenças autoimunes, algumas delas são espondilite anquilosante, hanseníase e doença celíaca
Tratamento
A única forma de tratar a doença celíaca é realizar uma dieta totalmente sem glúten de forma permanente. Para isso, deve-se eliminar alimentos compostos de trigo, cevada e centeio. Isso não é tarefa simples, pois boa parte dos alimentos industrializados contém estes cereais.
Por outro lado, há uma variedade de alimentos saudáveis permitidos que podem fazer parte da dieta de um celíaco:
CEREAIS: arroz, milho, painço e os pseudocereais quinoa, amaranto, trigo sarraceno.
FARINHAS e FÉCULAS: farinha de arroz, amido de milho (tipo “maisena”), fubá, farinha de mandioca, fécula de batata, farinha de soja, polvilho, araruta, flocos de arroz e milho.
MASSAS: feitas com as farinhas permitidas.
VERDURAS, FRUTAS E LEGUMES: todos, crus ou cozidos.
LATICÍNIOS: leite, manteiga, queijos e derivados (se não houver intolerância à lactose).
GORDURAS: óleos e azeites.
CARNES: bovina, suína, frango, peixes, ovos e frutos do mar.
GRÃOS: feijão, lentilha, ervilha, grão de bico, soja.
SEMENTES OLEAGINOSAS: nozes, amêndoas, amendoim, castanhas da Amazônia e caju, avelãs, macadâmias, linhaça, gergelim, abóbora, etc
Links:
http://www.fenacelbra.com.br/fenacelbra/http://portalarquivos.saude.gov.br/images/pdf/2016/fevereiro/05/Doen–a-Cel–aca—PCDT-Formatado—port1449-2015.pdf
https://veja.abril.com.br/saude/doenca-celiaca-mata-42-000-criancas-todo-ano-no-mundo/
https://drauziovarella.uol.com.br/pediatria/a-doenca-do-gluten/
Fonte:https://bioemfoco.com.br/noticia/conheca-as-formas-de-diagnostico-doenca-celiaca/

Comentários
Postar um comentário