
Uma revisão completa sobre doença celíaca, suas causas e apresentações, métodos diagnósticos, principais tratamentos e seus benefícios.
DOENÇA CELIÁCA - UMA REVISÃO COMPLETA
A doença celíaca (DC) é uma enteropatia crônica imunomediada do intestino delgado, desencadeada pela ingestão de glúten em indivíduos geneticamente predispostos e que afeta múltiplos órgãos. A doença é caracterizada pela presença de autoanticorpos específicos contra transglutaminase tissular 2, endomísio e/ou peptídeo de gliadina.
Antigamente considerada uma condição rara que afetava quase exclusivamente crianças brancas jovens, sabemos hoje que pode se desenvolver em qualquer idade e afetar praticamente qualquer raça.
A doença celíaca é comum em todo o mundo, e sua prevalência aumentou significativamente nos últimos 20 anos, variando de acordo com a população estudada, sendo descritas prevalências de 1 a 5%. No Brasil, estima-se 0,5% a 1,6%, porém sabemos haver alto índice de subnotificação. Em populações de alto risco, a prevalência é ainda mais alta, devendo sempre ser triados. Confira mais detalhes na Tabela a seguir.
DOENÇA CELÍACA: MANIFESTAÇÕES CLÍNICAS
referências 1,2,3,4,6,7,16
A DC é uma entidade de extrema importância em pediatria devido à enorme gama de manifestações em que pode se apresentar. Listamo-nas na Tabela 2 a seguir:
CLASSIFICAÇÕES DA DOENÇA CELÍACA
referências 15,16,3,21
DC clássica
Apresenta-se com sinais e sintomas de má absorção: diarreia, esteatorreia, insuficiência de crescimento ou perda de peso. Crianças frequentemente apresentam déficit pôndero-estatural, apetite pobre, hipotrofia muscular glútea e distensão abdominal, além de poderem apresentar sinais de sofrimento emocional (alteração de humor) e letargia.
DC extraintestinal ou não clássica
Apresenta-se sem sinais e/ou sintomas de má absorção. Pacientes podem apresentar dor abdominal recorrente, constipação refratária ou manifestações extraintestinais.
Subclínica
São os pacientes que não apresentam sintomas sugestivos, mas possuem teste sorológico positivo e biópsia com evidência de atrofia de vilosidades. Esses casos geralmente são detectados pela triagem de grupos de alto risco (ver Tabela 1 acima). O termo “silencioso”, empregado até pouco tempo atrás, se faz impróprio, uma vez que muitos desses pacientes que realizam dieta de isenção de glúten acabam por reconhecer posteriormente alguns sintomas que pensavam ser normais.
Potencial
Indivíduos que têm resultados positivos para anticorpos específicos de DC, mas nunca apresentaram biópsia compatível com a doença e são assintomáticos. Esses indivíduos são identificados em testes de triagem por pertencerem a grupos de alto risco. A maioria deles não irá desenvolver a doença.
Latente
Indivíduos que apresentaram todos os critérios diagnósticos em algum momento da vida, mas posteriormente recuperaram e tiveram uma biópsia duodeno/jejunal normal e pouco ou nenhum sintoma, mesmo numa dieta composta por glúten. Em muitos casos, a DC foi inicialmente diagnosticada durante a infância e tratada com dieta isenta de glúten; a partir de então, a doença permaneceu quiescente, apesar de retomada de uma dieta normal.
DIAGNÓSTICO
referências 1,2,3,4,5,6,7,15,17
Na prática clinica, a dosagem de IgA antitransglutaminase tecidual (anti-tTG) (ou classe IgG em pacientes com deficiência de IgA, portanto deve-se sempre dosá-la) é o método de escolha atual pelo melhor custo-benefício e confiabilidade. Em crianças menores de 2 anos, os testes sorológicos podem não ser tão acurados, portanto recomenda-se sempre dosar anti-tTG e IgG antigliadina deaminada (AGD) em conjunto. AGD apresenta uma sensibilidade e especificidade próximas ao IgA anti-tTG e deve ser usado como o teste de triagem inicial para pacientes com deficiência de IgA.
A dosagem de anticorpos IgA antiendomisio (EMA) é 98% específica para doença celíaca ativa, mas deve ser usada apenas como teste de confirmação, devido ao custo mais elevado e à interpretação subjetiva, apresentando uma sensibilidade variável.
Testes sorológicos para DC são dependentes do consumo de glúten, e a isenção dele na dieta pode resultar em falso-negativos. Embora a duração exata do consumo de glúten necessário antes dos testes não seja conhecida, os especialistas concordam que a ingestão de 10 g de glúten (equivalente a 2 fatias de pão de trigo integral) por dia, durante 8 semanas, deva permitir uma interpretação fidedigna.3
A pesquisa de HLA-DQ2 e HLA-DQ8 pode ser útil quando há discrepância entre os estudos sorológicos e achados histológicos, pois sua negatividade praticamente exclui a DC.
A pesquisa diagnóstica pode ser realizada conforme o seguinte Algoritmo:
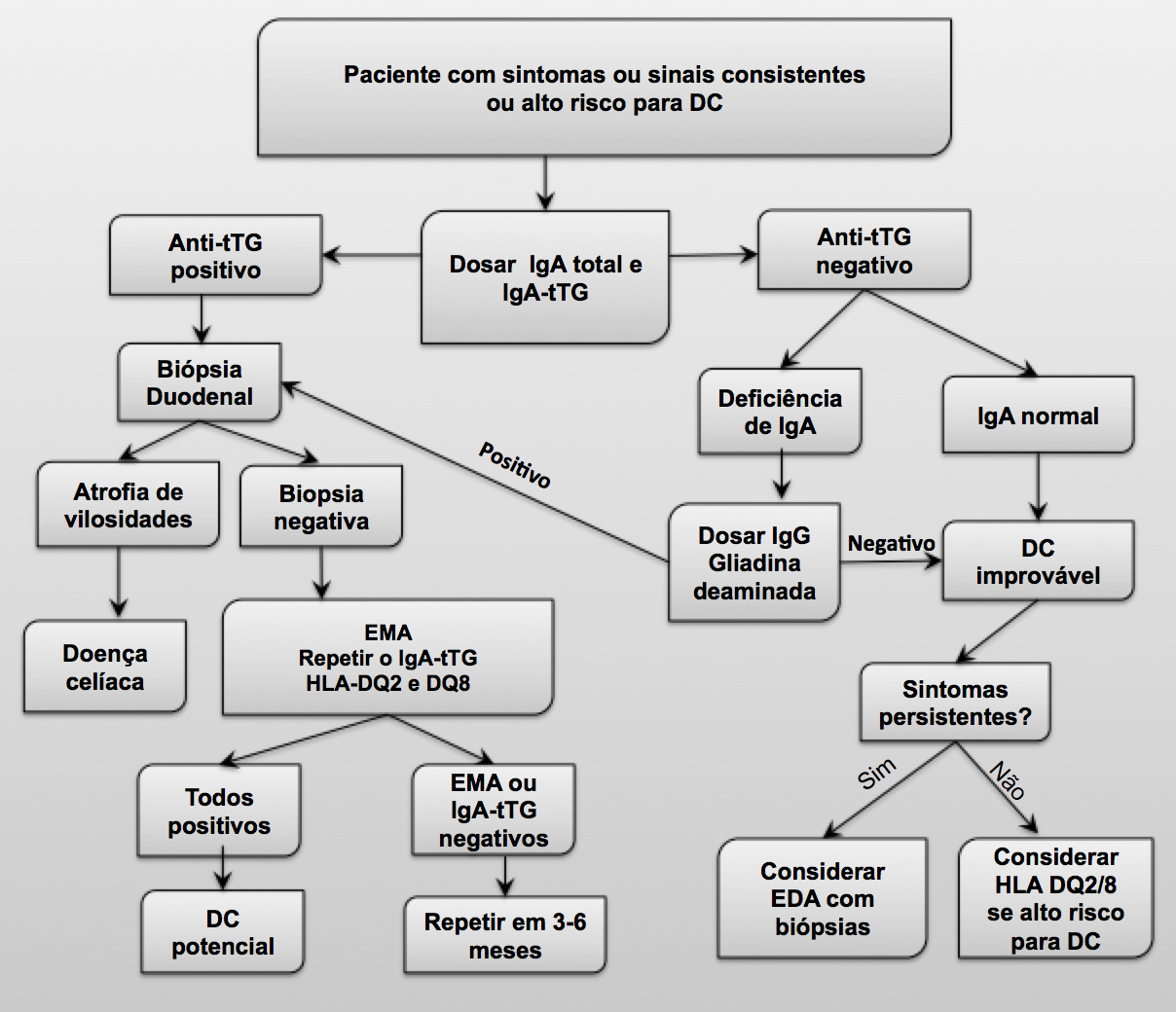
*tTG: anti-transglutaminase *EMA: anti-endomisio *EDA: endoscopia digestiva alta
DIAGNÓSTICO HISTOLÓGICO DA DOENÇA CELÍACA
referências 1,2,3,4,5,6,7,15,17
Um amplo espectro de sinais histológicos pode estar presente, variando de uma arquitetura vilosa normal até atrofia severa das vilosidades. No entanto, estas alterações não são patognomônicas de DC e a maioria delas pode ser vista em outras entidades, tais como alergias alimentares (principalmente à proteína do leite de vaca ou soja), doença de Crohn e infecções virais, bacterianas ou parasitárias (em destaque Giardia lamblia, devendo-se sempre que possível dosar antígeno fecal de giardia).
As biópsias de intestino delgado — que devem ser realizadas na segunda e terceira porções do duodeno (pelo menos 4 amostras), e com pelo menos 1 biópsia do bulbo duodenal — estabelecem o diagnóstico definitivo da DC. Sua classificação e achados histológicos compatíveis são dados pelos critérios de Marsh conforme a Tabela 3 abaixo demonstra.
As biópsias de intestino delgado estabelecem o diagnóstico definitivo da DC.
* > 40 linfócitos intraepiteliais por 100 enterócitos por Marsh modificado (Oberhuber);
> 25 linfócitos intraepiteliais por 100 enterócitos por Corazza.15
TRATAMENTO
referências 1,2,3,4,5,6,7,15,17

Dieta isenta de glúten (DIG) por toda a vida é a única opção de tratamento disponível; no entanto, aderir a essa dieta pode ser difícil, devido às pequenas quantidades de glúten que podem estar presentes em alimentos supostamente “sem glúten”. Estes traços podem ser tão prejudiciais quanto a falta de adesão à dieta.
O acompanhamento com gastroenterologista pediátrico e nutricionista é essencial para garantir o sucesso da DIG e evitar déficits nutricionais.
BENEFÍCIOS DO TRATAMENTO
referências 1,3,18
É claramente observada recuperação nutricional em pacientes com déficits.
Vários estudos sugerem que pacientes que têm a condição detectada durante uma triagem, mesmo quando eles se consideram assintomáticos, podem melhorar a qualidade de vida a longo prazo com uma DIG; nesses casos, após o tratamento, descobrem possuírem sintomas os quais achavam ser normais.
É importante lembrar, também, que portadores de DC têm risco aumentado para algumas doenças a longo prazo:
- Câncer — maior risco nos primeiros anos após o diagnóstico, retorno ao risco normal após 5 anos de tratamento;
- Linfomas malignos;
- Adenocarcinoma de intestino delgado;
- Tumores da orofaringe;
- Infertilidade sem causa aparente (12%);
- Prejuízo na saúde óssea e crescimento (30–40% de osteoporose);
- Fraturas ósseas — risco aumentado em 35% para pacientes com doença celíaca clássica sintomática;
- Risco aumentado de malignidades em adultos;
- Complicações na gestação, como parto prematuro, recém-nascido de baixo peso e aborto espontâneo.
CONCLUSÃO
A DC é uma enteropatia com alta prevalência no mundo todo e possui grande variabilidade de apresentação clínica, tornando seu diagnóstico muitas vezes desafiador. Sua evolução pode ser assintomática, nunca sendo diagnosticada, até quadros muito sintomáticos, que se não tratados irão levar a prejuízo no crescimento e desenvolvimento em crianças.
Devido a essa ampla variação de sintomas, às suas graves consequências, ao fato da DC ser uma doença de fácil rastreio e com tratamento bem estabelecido e eficaz, é importante que ocorra a conscientização dos médicos para que haja um aumento na sua suspeita e consequente maior número de diagnósticos.
BIBLIOGRAFIA
- Julio C. Bai, et.al, World Gastroenterology Organization Global Guidelines, Celiac Disease, 2016
- Ludvigsson JF, Leffler DA, Bai JC, et al. , The Oslo definitions for coeliac disease and related terms, Gut (2012). doi:10.1136/gutjnl-2011-301346
- Ivor D. Hill, yAlessio Fasano, zStefano Guandalini, §Edward Hoffenberg, jjJoseph Levy, ôNorelle Reilly, and #Ritu Verma, NASPGHAN Clinical Report on the Diagnosis and Treatment of Gluten-related Disorders, JPGN Volume 63, Number 1, July 2016
- S. Husby, et.al, ESPGHAN Working Group on Coeliac Disease Diagnosis, on behalf of the ESPGHAN Gastroenterology Committee, European Society for Pediatric Gastroenterology, Hepatology, and Nutrition Guidelines for the Diagnosis of Coeliac Disease, JPGN Volume 54, Number 1, January 2012
- Silvester JA, Kurada S, Szwajcer A, Kelly CP, Leffler DA, Duerksen DR, Tests for Serum Transglutaminase and Endomysial Antibodies Do Not Detect Most Patients With Celiac Disease and Persistent Villous Atrophy on Gluten-free Diets: a Meta-analysis, Gastroenterology (2017), doi: 10.1053/j.gastro.2017.05.015.
- Alberto Rubio-Tapia, MD1, Ivor D. Hill, MD2, Ciarán P. Kelly, MD3, Audrey H. Calderwood, MD4 and Joseph A. Murray, MD, ACG Clinical Guidelines: Diagnosis and Management of Celiac Disease, Am J Gastroenterol 2013; 108:656–676; doi:10.1038/ajg.2013.79; published online 16 April 2013
- Caminero A, Galipeau HJ, McCarville JL, Johnston CW, Bernier SP, Russell AK, Jury J, Herran AR, Casqueiro J, Tye-Din JA, Surette MG, Magarvey NA, Schuppan D, Verdu EF, Duodenal bacteria from patients with celiac disease and healthy subjects distinctly affect gluten breakdown and immunogenicity, Gastroenterology (2016), doi: 10.1053/j.gastro.2016.06.041.
- Tamara Pozo-Rubio, et al, Immune Development and Intestinal Microbiota in Celiac Disease, Clinical and Developmental Immunology Volume 2012, Article ID 654143, 12 pages doi:10.1155/2012/654143
- Marjet J. A. M. Braamskamp & Koert M. Dolman & Merit M. Tabbers, Protein-losing enteropathy in children, Eur J Pediatr (2010) 169:1179–1185 DOI 10.1007/s00431-010-1235-2
- Romain Bouziat, et.al.,Reovirus infection triggers inflammatory responses to dietary antigens and development of celiac disease, Science 356, 44–50 (2017) 7 April 2017
- Martin F.Kagnoff, et.al, possible role for a human adenovirus in the pathogenesis of celiac disease, j.exp.med.© Rockfeller university press vol.160 nov.1984 1544-1557.
- Pioneer in the gluten free diet: Willem-Karel Dicke 1905-1962, over 50 years of gluten free diet, gut 1993; 34:14730-1475
- Plot L1, Amital H. Infectious associations of Celiac disease, Autoimmun Rev. 2009 Feb;8(4):316-9. doi: 10.1016/j.autrev.2008.10.001. Epub 2008 Oct 29.
- Stene LC1, Honeyman MC, Hoffenberg EJ, Haas JE, Sokol RJ, Emery L, Taki I, Norris JM, Erlich HA, Eisenbarth GS, Rewers M., Rotavirus infection frequency and risk of celiac disease autoimmunity in early childhood: a longitudinal study. Am J Gastroenterol. 2006 Oct;101(10):2333-40.
- https://www.uptodate.com/contents/epidemiology-pathogenesis-and-clinical-manifestations-of-celiac-disease-in-children
- Auricchio R, Tosco A, Piccolo E, Galatola M, Izzo V, Maglio M, Paparo F, Troncone R, Greco L , Prevalence and natural history of potential celiac disease in at-family-risk infants prospectively investigated from birth., IPotential celiac children: 9-year follow-up on a gluten-containing diet., J Pediatr. 2012 Nov;161(5):908-914.e2. Epub 2012 Jun 15.
- Lionetti E, Castellaneta S, Pulvirenti A, Tonutti E, Francavilla R, Fasano A, Catassi C, Italian Working Group of Weaning and Celiac Disease Risk,J Pediatr. 2012 Nov;161(5):908-914.e2. Epub 2012 Jun 15.
- Maureen M. Leonard, MD, MMSc; Anna Sapone, MD, PhD; Carlo Catassi, MD, MPH; Alessio Fasano, MD, Celiac Disease and Nonceliac Gluten Sensitivity, A Review,JAMA.2017;318(7):647-656. doi:10.1001/jama.2017.9730
- Vécsei E, Steinwendner S, Kogler H, Innerhofer A, Hammer K, Haas OA, Amann G, Chott A, Vogelsang H, Schoenlechner R, Huf W, Vécsei A. Follow-up of pediatric celiac disease: value of antibodies in predicting mucosal healing, a prospective cohort study, BMC Gastroenterol. 2014 Feb 13;14:28. doi: 10.1186/1471-230X-14-28.
- Leonard MM1, Weir DC, DeGroote M, Mitchell PD, Singh P, Silvester JA, Leichtner AM, Fasano A., Value of IgA tTG in Predicting Mucosal Recovery in Children With Celiac Disease on a Gluten-Free Diet. J Pediatr Gastroenterol Nutr. 2017 Feb;64(2):286-291. doi: 10.1097/MPG.0000000000001460.
- Sapone A, Bai JC, Ciacci C, et al. Spectrum of gluten-related disorders: consensus on new nomenclature and classification. BMC Med 2012;10:13
Comentários
Postar um comentário